Что такое болезнь шарко
Образ жизни при болезни Шарко-Мари-Тута
БОЛЕЗНЬЮ ШАРКО-МАРИ-ТУТА СТРАДАЮТ ОКОЛО 3-Х МИЛЛИОНОВ ЧЕЛОВЕК ВО ВСЕМ МИРЕ. В КРАСНОЯРСКЕ И КРАСНОЯРСКОМ ЭТО НАСЛЕДСТВЕННОЕ ЗАБОЛЕВАНИЕ ПЕРИФЕРИЧЕСКИХ НЕРВОВ ТОЖЕ ДОСТАТОЧНО РАСПРОСТРАНЕНО. В НАШЕМ РЕГИОНЕ ЕГО ВСТРЕЧАЕМОСТЬ ДОСТИГАЕТ 10 СЛУЧАЕВ НА 100 ТЫСЯЧ ЧЕЛОВЕК. ОБРАЗ ЖИЗНИ (ВЫБОР ФИЗИЧЕСКИХ НАГРУЗОК, СПОРТА, СТИЛЯ ПИТАНИЯ) И ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ У НЕЙРОГЕНЕТИКА, ОРТОПЕДА И ПОДИАТРА МОЖЕТ СУЩЕСТВЕННО ЗАМЕДЛИТЬ ТЕМПЫ ПРОГРЕССИРОВАНИЯ ЗАБОЛЕВАНИЯ И УЛУЧШИТЬ КАЧЕСТВО ЖИЗНИ ПАЦИЕНТОВ.
Что такое болезнь Шарко-Мари-Тута?
Болезнь Шарко-Мари-Тута (синонимы: наследственная нейропатия Шарко-Мари-Тута, ШМТ, невральная амиотрофия) – наследственное заболевание периферической нервной системы, характеризующееся поражением чувствительных и двигательных нервов рук и ног.
Длинные волокна периферических нервов повреждаются сильнее, поэтому в первую очередь нарушаются функции наиболее удаленных (дистальных) отделов конечностей, испытывающих большую физическую нагрузку – это мышцы стоп и голеней. Мышцы кистей и предплечий обычно вовлекаются в патологический процесс в меньшей степени и на более поздних сроках развития заболевания.
Первые симптомы обычно появляются в возрасте 10-20 лет. Болезнь Шарко-Мари-Тута прогрессирует постепенно, исподволь:
Какие нагрузки следует избегать людям с болезнью Шарко-Мари-Тута?
Детям и взрослым, страдающим наследственной нейропатией Шарко-Мари-Тута (синоним: болезнь Шарко-Мари-Тута), необходимо избегать чрезмерных физических и психических перегрузок, так как это может спровоцировать ухудшение состояния (нарастание слабости в мышцах рук и ног и нарушение чувствительности в конечностях).
Какие виды спорта полезны при болезни Шарко-Мари-Тута?
Дозированные физические нагрузки, такие как лечебная гимнастика, пилатес, катание на велосипеде и плавание, рекомендуются для профилактики развития контрактур суставов нарастания выраженности мышечных атрофий.
Пловцу Донне ДеУвик (Donna DeWick) в 2004 году был установлен диагноз наследственной нейропатии Шарко-Мари-Тута. Пережив тяжелое потрясение в связи с этим сообщением врачей, а также осознав, что в период с 2004 по 2007 годы состояние ее здоровья стало резко ухудшаться, она решила взять под контроль свое здоровье и благополучие, сохранить свою мобильность. Со временем она использовала спорт не только как транспортное средство по сбору средств благотворительности, но и как способ поверить в свои силы. Недавно она участвовала в 7000-метровом заплыве через Большой Чесакпикский залив.
В выборе спортивных нагрузок и спортивной диеты при болезни Шарко-Мари-Тута важен междисциплинарный подход и помощь, как лечащего врача нейрогенетика, так и ортопеда – специалиста по ЛФК и спортивной медицине. Так подход с успехом реализован на базе Неврологического центра Университетской клиники, где детям и взрослым подбирается индивидуальная программа спортивных нагрузок в тренажерном зале, бассейне, а также в домашних условиях в зависимости от характера и степени тяжести заболевания, возраста пациента. Консультирование и сопровождение пациентов совместно с нейрогенетиками центра осуществляет специалист по ЛФК и спортивной медицине Сергей Валентинович Невзоров.
Что необходимо предпринять для профилактики деформаций стоп?
В качестве профилактики развития ранней деформации стоп, необходимо носить удобную, не стесняющую стопы, обувь. Соответствующая обувь является очень важным пунктом для людей, страдающих наследственной нейропатией Шарко-Мари-Тута, но часто они испытывают трудности при поиске подходящей им обуви из-за высокого подъема и специфической формы ноги («полая стопа») и пальцев ног («молоточкообразные пальцы»).
Аномалии ходьбы могут быть исправлены путем использования разных типов подтяжек, которые называются AFOs (ankle-foot orthoses). Эти крепления помогают контролировать тыльное сгибание ноги и голени, нестабильность голеностопного сустава и, зачастую, обеспечивают лучшее чувство равновесия. Ортезы позволяют пациентам максимально долго оставаться физически активными, самостоятельно передвигаться, предотвращая падения и получение травм.
Ортезы для фиксации стопы в физиологическом положении используются при синдроме «свисающей стопы».
Екатерина Александровна Козулина, кандидат медицинских наук, нейрогенетик, ведущий специалист по наследственной нейромышечной патологии Неврологического центра Университетской клиники поможет подобрать ортезы в зависимости от индивидуальных особенностей детей, подростков и взрослых, страдающих наследственной нейропатией Шарко-Мари-Тута, а также от выраженности амиотрофий и типа локомоторных нарушений. Некоторые люди для стабильности походки нуждаются в костылях или трости, и менее 5% нуждаются в инвалидных креслах.
Какой образ питания рекомендуется детям и взрослым, страдающим болезнью Шарко-Мари-Тута?
Пациенты должны придерживаться хорошо сбалансированной диеты, чтобы избежать ожирения, которое может способствовать возникновению боли в пояснице и оказывает дополнительную нагрузку на ослабленные мышцы. Пища должна быть богата антиоксидантами (витамины Е, С, А, селен).
Может ли прием лекарств негативно влиять на тяжесть заболевания?
Людям, страдающим наследственной нейропатией Шарко-Мари-Тута, необходимо избегать приема лекарственных препаратов, оказывающих токсическое действие на периферическую нервную систему, нарушающих функцию пораженных при ШМТ нервов [Weimer W. et al., 2006]. http://www.krasmedic.ru/article/?idc=50&ids=&ida=615
Авторы: Наталья Алексеевна Шнайдер, заведующая кафедрой медицинской генетики и клинической нейрофизиологии ИПО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого, руководитель Неврологического центра Университетской клиники, д.м.н., проф.;
Екатерина Александровна Козулина, к.м.н., невролог-нейрогенетики Неврологического центра Университетской клиники
Елена Владимировна Глущенко, к.м.н., ассистент кафедры, невролог-нейрогенетик
©Авторские права защищены. При использовании материала ссылки на авторов, сайт Университетской клиники и КрасГМУ им. проф. В.Ф. Войно-Ясенецкого обязательны.
Болезнь Шарко
Болезнь Шарко (в литературе еще встречается как «Болезнь Шарко-Мари», «Болезнь Шарко-Мари-Тута», код по МКБ- G60) –генетически обусловленное хроническое заболевание нервной системы, которое характеризуется развитием постоянно прогрессирующей периферической полинейропатией.
Частота диагностирования болезни Шарко-Мари-Тута согласно статистическим данным где-то один случай на две с половиною тысячи пациентов. Первые симптомы появляются в молодом возрасте. Выраженность симптомов и скорость прогрессирования болезни Шарко-Мари разная у каждого пациента. Процент инвалидизации при заболевании очень высок.
Причины заболевания болезнью Шарко:
Заболевание имеет много форм, вызванные разным видом мутаций. Качество жизни и возможности работоспособности при болезни Шарко-Мари-Тута значительно ухудшаются, но на продолжительности жизни обычно это не сказывается.
Симптомы болезни Шарко связанные с поражением моторных и сенсорных нервных волокон. Диагностика болезни Шарко-Мари заключается в исключении диагнозов, которые могут давать подобную клиническую картину, и в проведении ДНК-диагностики, но учитывая, что не все виды мутаций известны, она не всегда информативна.
Лечение болезни Шарко-Мари-Тута заключается в симптоматической терапии. Специфическое лечение на данный момент все еще находится в стадии разработки.
Юсуповская больница – одно из лучших медицинских учреждений, где лечатся пациенты с болезнью Шарко-Мари-Тута. Несмотря на то, что терапия направлена только на купирование симптомов, неврология стремительно развивается и питается найти способы лечения многих заболеваний, в том числе и болезни Шарко. Ведение пациентов изданной патологией достаточно сложное, ведь клиническая картина разнообразна, симптомы выражены в неодинаковой степени и п.т. Опыт работы специалистов Юсуповской больницы позволяет оказывать качественную и эффективную медицинскую помощь. Доктора следят за клиническими исследованиями, новыми разработками, препаратами, изучают их эффективность. В случае необходимости, диагностика проводится быстро и с использованием нового оборудования. Персонал работает на благо пациента.
Симптомы болезни Шарко
Симптомы болезни Шарка-Мари появляются в молодом возрасте, чаще всего до двадцати лет. Прогрессирует заболевание постепенно, пациенты долгое время сохраняют работоспособность и возможность самообслуживания. Причинами, которые ускоряют развитие заболевания, могут стать вирусные и бактериальные инфекции, воздействия неблагоприятных факторов среды, травматизм, недостаток витаминов и т.п.
По МКБ-10 болезнь Шарко-Мари-Тута кодируется как «G60 Наследственная моторная и сенсорная невропатия», что связано в какой-то мере с клинической картиной.
В начале заболевания беспокоит чрезмерная усталость, невозможность долго стоять на одном месте, чувство онемения, «беганье мурашек», а дальше присоединяется атрофическое поражение мышц стоп, которое чаще носит симметричный характер. При обследовании выявляют выпадение сухожильных рефлексов. Стопа деформируется на столько, что больные не могут ходить, опираясь на пятки. Прогрессируя, атрофический процесс поражает голени и бедра.
Все виды чувствительности нарушаются, но больше всего страдает поверхностная, особенно температурная.
Диагностика болезни Шарко
Полное обследование необходимо для исключения заболеваний, в которых клиническая картина сходна. К ним относят: боковой амиосклероз, миотония, метаболическая невропатия. Для исключения хронических полинейропатий проводят биопсию мышц.
Лечение болезни Шарко
Все способы лечения болезни Шарко-Мари-Тута не радикальны. Симптоматическое лечение включает медикаментозную терапию, физиотерапию, лечение у ортопеда и т.п.
Физиотерапевтическое лечение болезни Шарко-Мари-Тута включает ЛФК, массаж, электрофорез, диадинамотерапию, терапию лечебными грязями, разные виды ванн и др.
Медикаментозная терапия направлена на улучшение питания мышечных волокон. С этой целью назначают кокарбоксилазу, глюкозу, аденозинтрифосфат и др. Так же широко применяют антиоксидантные средства, препараты, улучшающие микроциркуляцию, и витамины. Хорошо зарекомендовали себя препараты, которые тормозят активность ацетилхолинэстеразы и повышают уровень ацетилхолина, например, прозерин, галантамин.
Дальнейшие разработки новых препаратов, направленные на радикальные меры – это мир без болезни Шарко-Мари-Тута. Прогрессирование болезни Шарко-Мари-Тута не отражается на том, сколько живут пациенты.
В Юсуповской больнице специалисты долгие годы помогают пациентам держать болезнь под контролем. Минимальная выраженность симптомов и медленное прогрессирование – результат работы врачей. В комфортных палатах, на новых тренажерах, в хорошо оснащенных кабинетах – вот где проходит лечение болезни Шарко-Мари-Тута. Не затягивайте с лечением, запишитесь на консультацию.
Болезнь Шарко-Мари-Тута
Содержание страницы
 Что такое болезнь Шарко-Мари-Тута (БШМТ)?
Что такое болезнь Шарко-Мари-Тута (БШМТ)?
Своё название болезнь Шарко-Мари-Тута (БШМТ) получила в честь трёх врачей, которые впервые в 1886 году описали это неврологическое расстройство — Жан-Мартен Шарко и Пьер Мари (Франция) и Говард Генри Тут (Соединенное Королевство).
БШМТ является наиболее распространённым наследственным заболеванием периферической нервной системы, которое поражает примерно 1 человека из 2500 человек. БШМТ приводит к повреждению периферических нервов, которые проводят сигналы от головного и спинного мозга к мышцам и передают ощущения (такие как боль или прикосновения) от различных частей тела к головному и спинному мозгу.
Существует большое количество типов БШМТ.
Симптомы болезни Шарко-Мари-Тута
БШМТ вызывает мышечную слабость и атрофию, а также потерю чувствительности в ступнях, нижней части ног, кистях и предплечьях. При БШМТ также часто появляются контрактуры (скованность суставов из-за аномальной жёсткости мышц и связанных с ними тканей), также может возникнуть искривление позвоночника (сколиоз).
В тяжёлых случаях болезнь может повлиять и на другие нервы. Повреждение нервов диафрагмы или межрёберных нервов может привести к респираторным нарушениям. Для получения дополнительных сведений см. раздел Признаки и симптомы на сайте mda.org.
Из-за чего появляется болезнь Шарко-Мари-Тута?
БШМТ возникает из-за дефектов в генах, кодирующих белки, которые, в свою очередь, влияют на аксоны — волокна, проводящие электрические сигналы между головным и спинным мозгом и остальными частями тела. Также БШМТ может возникнуть из-за дефектов в генах, кодирующих белки, влияющие на миелин — изолирующую и питательную оболочку аксонов.
Известно более 80 генов, дефекты в которых могут привести к БШМТ. Каждый ген связан с определённым типом БШМТ, а во многих случаях — с несколькими типами БШМТ.
Существует несколько вариантов наследования БШМТ:
Более подробную информацию о причинах и закономерностях наследования при БШМТ см. раздел Причины / наследование на сайте mda.org.
Прогрессирование болезни Шарко-Мари-Тута
В зависимости от своего типа заболевание может проявиться как при рождении, так и в зрелом возрасте. БШМТ прогрессирует, как правило, медленно и обычно не угрожает жизни. БШМТ почти никогда не влияет на мозг.
Статус исследований болезни Шарко-Мари-Тута
Исследования БШМТ сосредоточены на изучении влияния генетических дефектов на периферическую нервную систему и на разработках стратегий борьбы с последствиями этого влияния.
Важно знать при БШМТ!
Всегда консультируйтесь с врачами.
Организации и сообщества, посвящённые болезни Шарко-Мари-Тута
Основное русскоязычное сообщество «Мир без болезни Шарко-Мари-Тута»:
Зарубежные организации и сообщества:
Важно! Регистры пациентов с болезнью Шарко-Мари-Тута
Почему нужно регистрироваться в реестре?
По мере того, как разрабатываются новые препараты, появляется необходимость их тестирования в клинических условиях, и иногда требуются годы, чтобы найти необходимое количество пациентов для исследований, поскольку болезнь Шарко-Мари-Тута является редким (орфанным) заболеванием.
Для этого в разных странах ведутся реестры пациентов с БШМТ — базы данных по генетической и клинической информации о людях, страдающих БШМТ и желающих ускорить процесс исследований. Реестр позволяет специалистам получить информацию о состоянии и количестве больных данным заболеванием. Данная информация способствует развитию и улучшению стандартов лечения пациентов. Он используется, чтобы найти участников для проведения клинических испытаний, а также помочь специалистам получить больше информации о заболевании.
Публикации в СМИ
Болезнь Шарко–Мари–Тута
Болезнь Шарко–Мари–Тута объединяет наследственные сенсомоторные невропатии типов I и II. Заболевание характеризующаяся слабостью и атрофией дистальной группы мышц нижних конечностей и обычно аутосомно-доминантным типом наследования; часто сочетается с другими нейродегенеративными заболеваниями (например, с атаксией Фридрайха).
Генетические аспекты и классификация. Типы и гены: • тип 1A: 118220, PMP22, CMT1A, 601097 (белок 22 миелина), 17p11.2; • тип 1B: 118200, MPZ, CMT1B, 159440, 1q22; • тип 2A: CMT2A, 118210, 1p36 p35; • тип 2B: CMT2B, 600882, 3q13 q22; • тип 2D: CMT2D, 601472, 7p14; • тип 4A: CMT4A, 214400, 8q13 q21.1; • тип 4B: CMT4B, 601382, 11q23; • X сцепленная 1, доминантная: 302800, GJB1, CMTX1, 304040 (ген коннексина CX32, Xq13.1); • X сцепленная 2, рецессивная: CMTX2, 302801, Xp22.2; • демиелинизирующая: CMTND, 601596, 5q23 q33; • с аплазией кожи (302803) • с ладонно-подошвенной кератодермией и дистрофией ногтей (148360) • синдром Коучока (310490) • с атаксией Фридрайха (302900) • с глухотой (118300, 214370) • с тремором (214380) • с птозом и паркинсонизмом (118301)
Патоморфология • Наследственная сенсомоторная невропатия типа I — гистологически определяется сегментарная демиелинизация и ремиелинизация, концентрический рост шванновских клеток (гипертрофическая невропатия) • Наследственная сенсомоторная невропатия типа II — гистологически определяется уоллеровская дегенерация.
Клиническая картина • Наследственная сенсомоторная невропатия типа I •• Начало в среднем детском возрасте •• Слабость разгибателей стопы (свисающая стопа) •• Медленно прогрессирующая атрофия дистальных групп мышц ног (ноги аиста) •• Атрофия мышц кистей развивается позже •• Снижение вибрационной, болевой и температурной чувствительности по типу чулок •• Сухожильные рефлексы снижаются и исчезают •• Утолщённые нервы иногда доступны пальпации •• Аномальное увеличение свода стопы (pes cavus) часто бывает единственным признаком у гетерозиготных носителей дефектного гена •• Течение медленно прогрессирующее, заболевание практически не оказывает влияния на продолжительность жизни • Наследственная сенсомоторная невропатия типа II •• Начало мышечной слабости в возрасте 16–30 лет •• Заболевание прогрессирует медленнее, чем болезнь Шарко–Мари–Тута I типа.
Лабораторные исследования • Болезнь Шарко–Мари–Тута I типа •• Снижение скорости проведения по нервам •• Удлинение дистальной латентности • Болезнь Шарко–Мари–Тута II типа •• Скорость проведения по нервам обычно нормальная •• Снижение амплитуды вызванных потенциалов.
Лечение • Специфическое лечение отсутствует • Выбор профессии должен осуществляться с учётом медленного прогрессирования заболевания • Фиксаторы применяют при свисающей стопе • Ортопедическая коррекция стопы.
Синонимы •• Шарко–Мари мышечная атрофия •• Мышечная атрофия перонеального типа •• Амиотрофия наследственная невральная
МКБ-10 • G60.0 Наследственная моторная и сенсорная невропатия
Код вставки на сайт
Болезнь Шарко–Мари–Тута
Болезнь Шарко–Мари–Тута объединяет наследственные сенсомоторные невропатии типов I и II. Заболевание характеризующаяся слабостью и атрофией дистальной группы мышц нижних конечностей и обычно аутосомно-доминантным типом наследования; часто сочетается с другими нейродегенеративными заболеваниями (например, с атаксией Фридрайха).
Генетические аспекты и классификация. Типы и гены: • тип 1A: 118220, PMP22, CMT1A, 601097 (белок 22 миелина), 17p11.2; • тип 1B: 118200, MPZ, CMT1B, 159440, 1q22; • тип 2A: CMT2A, 118210, 1p36 p35; • тип 2B: CMT2B, 600882, 3q13 q22; • тип 2D: CMT2D, 601472, 7p14; • тип 4A: CMT4A, 214400, 8q13 q21.1; • тип 4B: CMT4B, 601382, 11q23; • X сцепленная 1, доминантная: 302800, GJB1, CMTX1, 304040 (ген коннексина CX32, Xq13.1); • X сцепленная 2, рецессивная: CMTX2, 302801, Xp22.2; • демиелинизирующая: CMTND, 601596, 5q23 q33; • с аплазией кожи (302803) • с ладонно-подошвенной кератодермией и дистрофией ногтей (148360) • синдром Коучока (310490) • с атаксией Фридрайха (302900) • с глухотой (118300, 214370) • с тремором (214380) • с птозом и паркинсонизмом (118301)
Патоморфология • Наследственная сенсомоторная невропатия типа I — гистологически определяется сегментарная демиелинизация и ремиелинизация, концентрический рост шванновских клеток (гипертрофическая невропатия) • Наследственная сенсомоторная невропатия типа II — гистологически определяется уоллеровская дегенерация.
Клиническая картина • Наследственная сенсомоторная невропатия типа I •• Начало в среднем детском возрасте •• Слабость разгибателей стопы (свисающая стопа) •• Медленно прогрессирующая атрофия дистальных групп мышц ног (ноги аиста) •• Атрофия мышц кистей развивается позже •• Снижение вибрационной, болевой и температурной чувствительности по типу чулок •• Сухожильные рефлексы снижаются и исчезают •• Утолщённые нервы иногда доступны пальпации •• Аномальное увеличение свода стопы (pes cavus) часто бывает единственным признаком у гетерозиготных носителей дефектного гена •• Течение медленно прогрессирующее, заболевание практически не оказывает влияния на продолжительность жизни • Наследственная сенсомоторная невропатия типа II •• Начало мышечной слабости в возрасте 16–30 лет •• Заболевание прогрессирует медленнее, чем болезнь Шарко–Мари–Тута I типа.
Лабораторные исследования • Болезнь Шарко–Мари–Тута I типа •• Снижение скорости проведения по нервам •• Удлинение дистальной латентности • Болезнь Шарко–Мари–Тута II типа •• Скорость проведения по нервам обычно нормальная •• Снижение амплитуды вызванных потенциалов.
Лечение • Специфическое лечение отсутствует • Выбор профессии должен осуществляться с учётом медленного прогрессирования заболевания • Фиксаторы применяют при свисающей стопе • Ортопедическая коррекция стопы.
Синонимы •• Шарко–Мари мышечная атрофия •• Мышечная атрофия перонеального типа •• Амиотрофия наследственная невральная
МКБ-10 • G60.0 Наследственная моторная и сенсорная невропатия
Боковой (латеральный) амиотрофический склероз (и синдром БАС)
Боковой (латеральный) амиотрофический склероз (БАС) (также известен как болезнь моторных нейронов, Мотонейронная болезнь, болезнь Шарко, в англоязычных странах — болезнь Лу Герига) — прогрессирующее, неизлечимое дегенеративное заболевание центральной нервной системы, при котором происходит поражение как верхних (моторная кора головного мозга), так и нижних (передние рога спинного мозга и ядра черепно-мозговых нервов) двигательных нейронов, что приводит к параличам и последующей атрофии мышц.
Болезнь известна не так давно. Впервые описана Жан-Мартеном Шарко в 1869г. По статистике выявляется у 2-5 человек на 100 000 населения в год, что говорит о том, что данная патология относительно редко встречается. Всего в мире насчитывается около 70 тысяч больных боковым амиотрофическим склерозом. Обычно заболевание заявляет о себе у людей старше 50 лет.
Совсем недавно было высказано мнение, что случаи бокового амиотрофического склероза чаще регистрируются у высокоинтеллектуальных людей, профессионалов в своем деле, а также у спортсменов-атлетов, которые на протяжении всей жизни отличались крепким здоровьем.
Точная этиология БАС неизвестна.
Сущность болезни заключается в дегенерации двигательных нейронов, т.е. под воздействием ряда причин запускается процесс разрушения нервных клеток, ответственных за сокращения мышц. Этот процесс затрагивает нейроны коры больших полушарий, ядер головного мозга и нейроны передних рогов спинного мозга. Двигательные нейроны погибают, а их функции никто больше не выполняет. Нервные импульсы к мышечным клеткам больше не поступают. И мышцы слабеют, развиваются парезы и параличи, атрофия мышечной ткани.
Если в основе бокового амиотрофического склероза лежит мутация в гене супероксиддисмутазы-1, то процесс выглядит примерно следующим образом. Мутантная супероксиддисмутаза-1 накапливается в митохондриях двигательных нейронов (в энергетических станциях клетки). Это «мешает» нормальному внутриклеточному транспорту белковых образований. Белки соединятся друг с другом, как бы слипаются, и это запускает процесс дегенерации клетки.
Если причиной становится избыток глутамата, то механизм запуска разрушения двигательных нейронов выглядит так: глутамат открывает каналы в мембране нейронов для кальция. Кальций устремляется внутрь клеток. Избыток кальция, в свою очередь, активирует внутриклеточные ферменты. Ферменты как бы «переваривают» структуры нервных клеток, при этом образуется большое количество свободных радикалов. И эти свободные радикалы повреждают нейроны, постепенно приводя к их полному разрушению.
Предполагается, что роль других факторов в развитии БАС также заключается в запуске свободнорадикального окисления.
Классификация БАС, формы:
Общими симптомами, характерными для любой из форм бокового амиотрофического склероза, являются:
Начальные проявления заболевания:
•слабость в дистальных отделах рук, неловкость при выполнении тонких движений пальцами, похудание в кистях и фасцикуляции (мышечные подергивания)
•реже заболевание дебютирует слабостью в проксимальных отделах рук и плечевом поясе, атрофиями в мышцах ног в сочетании с нижним спастическим парапарезом
•возможно также начало заболевания с бульбарных расстройств – дизартрии и дисфагии (25% случаев)
•крампи (болезненные сокращения, спазмы мышц), нередко генерализованные, встречаются практически у всех больных БАС, и нередко являются первым признаком заболевания
Для БАС в большинстве случаев характерна асимметричность симптоматики.
При этой форме заболевания возможно два варианта:
Также может дебютировать двумя способами:
В руках по мере прогрессирования болезни формируется парез с атрофическими изменениями, повышением рефлексов, повышением тонуса и патологическими стопными признаками. Аналогичные изменения возникают и в ногах, но несколько позже.
Это разновидность бокового амиотрофического склероза, когда заболевание протекает с преимущественным поражением центрального мотонейрона. При этом во всех мышцах туловища и конечностей формируются парезы с повышением мышечного тонуса, патологическими симптомами.
Бульбарная и высокая формы БАС являются прогностически неблагоприятными. Больные с таким началом заболевания имеют меньшую продолжительность жизни по сравнению с шейно-грудной и пояснично-крестцовой формами. Какими бы ни были первые проявления заболевания, оно неуклонно прогрессируют.
Парезы в различных конечностях приводят к нарушению способности самостоятельно передвигаться, обслуживать себя. Вовлечение в процесс дыхательной мускулатуры приводит вначале к появлению одышки при физической нагрузке, затем одышка беспокоит уже в покое, появляются эпизоды острой нехватки воздуха. В терминальных стадиях самостоятельное дыхание просто невозможно, больным требуется постоянная искусственная вентиляция легких.
Продолжительность жизни больного БАС составляет по разным данным от 2 до 12 лет, однако более 90% больных умирают в течение 5 лет от момента постановки диагноза. В терминальную стадию болезни больные полностью прикованы к постели, дыхание поддерживается с помощью аппарата искусственной вентиляции легких. Причиной гибели таких больных может стать остановка дыхания, присоединение осложнений в виде пневмонии, тромбоэмболии, инфицирования пролежней с генерализацией инфекции.
Среди параклинических исследований наиболее существенное диагностическое значение имеет электромиография. Выявляется распространенное поражение клеток передних рогов (даже в клинически сохранных мышцах) с фибрилляциями, фасцикуляциями, позитивными волнами, изменениями потенциалов двигательных единиц (увеличивается их амплитуда и длительность) при нормальной скорости проведения возбуждения по волокнам чувствительных нервов. Содержание КФК в плазме может быть незначительно повышено
Боковой амиотрофический склероз нужно заподозрить:
•при развитии слабости и атрофий, а возможно и фасцикуляций (мышечных подергиваний) в мышцах кисти
•при похудания мышц тенара одной из кистей с развитием слабости аддукции (приведения) и оппозиции большого пальца (обычно асимметрично)
•при этом наблюдается затруднение при схватывании большим и указательным пальцами, затруднения при подбирании мелких предметов, при застегивании пуговиц, при письме
•при развитии слабости в проксимальных отделах рук и плечевом поясе, атрофий в мышцах ног в сочетании с нижним спастическим парапарезом
•при развитии у пациента дизартрии (нарушений речи) и дисфагии (нарушений глотания)
•при появлении у пациента крампи (болезненных мышечных сокращений)
Диагностические критерии БАС:
Критерии подтверждения БАС:
Диагноз БАС подьверждается:
Дифференциальный диагноз БАС (синдромы похожие на БАС):
•Спондилогенная шейная миелопатия.
•Опухоли краниовертебральной области и спинного мозга.
•Краниовертебральные аномалии.
•Сирингомиелия.
•Подострая комбинированная дегенерация спинного мозга при недостаточности витамина В12.
•Семейный спастический парапарез Штрюмпеля.
•Прогрессирующие спинальные амиотрофии.
•Постполиомиелитический синдром.
•Интоксикации свинцом, ртутью, марганцем.
•Недостаточность гексозаминидазы типа А у взрослых при ганглиозидозе GM2.
•Диабетическая амиотрофия.
•Мультифокальная моторная невропатия с блоками проведения.
•Болезнь Крейцтфельдта-Якоба.
•Паранеопластический синдром, в частности при лимфогранулематозе и злокачественной лимфоме.
•Синдром БАС при парапротеинемии.
•Аксональная нейропатия при болезни Лайма (Лайм-боррелиозе).
•Синдром Гийена-Барре.
•Миастения.
•Рассеянный склероз
•Эндокринопатии (тиреотоксикоз, гиперпаратиреоз, диабетическая амиотрофия).
•Доброкачественные фасцикуляции, т.е. фасцикуляции, продолжающиеся годами без признаков поражения двигательной системы.
•Нейроинфекции (полиомиелит, бруцеллез, эпидемический энцефалит, клещевой энцефалит, нейросифилис, болезнь Лайма).
•Первичный боковой склероз.
Диагностические исследования при синдроме БАС.
Для уточнения диагноза и проведения дифференциального диагноза при синдроме БАС рекомендутся следующее обследование больного:
Анализ крови (СОЭ, гематологические и биохимические исследования)
Рентгенография органов грудной клетки
Исследование функций щитовидной железы
Определение содержания витамина В12 и фолиевой кислоты в крови
Креатинкиназа в сыворотке
МРТ головного мозга и при необходимости, спинного мозга
Эффективного лечения заболевания не существует. Единственный препарат, ингибитор высвобождения глутамата рилузол (Рилутек), отодвигает летальный исход на 2 – 4 месяца. Его назначают по 50 мг два раза в день.
Основу лечения составляет симптоматическая терапия:
•Физическая активность. Пациент должен по мере своих возможностей поддерживать физическую активность По мере прогрессирования заболевания возникает необходимость в кресле-каталке и других специальных приспособлениях.
•Диета. Дисфагия создаёт опасность попадания пищи в дыхательные пути • Иногда возникает необходимость в питании через зонд или в гастростомии.
•Применение ортопедических приспособлений: шейного воротника, различных шин, устройств для захвата предметов.
•При крампи (болезненным мышечных спазмах): карбамазепин (Финлепсин, Тегретол) и/или витамин Е, а также препараты магния, верапамил (Изоптин).
•При спастичности: баклофен (Баклосан), Сирдалуд, а также клоназепам.
•При слюнотечении атропин, или гиосцин (Бускопан).
•При невозможности приема пищи вследствие нарушения глотания накладывают гастростому или вводят назогастральный зонд. Раннее проведение чрезкожной эндоскопической гастростомии продлевает жизнь пациентов в среднем на 6 месяцев.
•Церебролизин в высоких дозах (10-30 мл в/в капельно 10 дней повторными курсами). Существует ряд небольших исследований, показывающих нейропротективную эффективность церебролизина при БАС.
•Антидепрессанты: Серталин или Паксил или Амитриптилин (часть больных БАС предпочитает именно его как раз из-за побочных действий – он вызывает сухость во рту, соответственно уменьшает гиперсаливацию (слюнотечение), часто мучающую больных БАС).
•При появлении дыхательных нарушений: искусственная вентиляция легких в условиях стационаров, как правило, не проводится, но некоторые больные приобретают портативные приборы ИВЛ и проводят ИВЛ в домашних условиях.
•Ведутся разработки к применению гормона роста, нейротрофических факторов при БАС.
•Последнее время активно ведутся разработки лечения стволовыми клетками. Этот метод обещает быть перспективным, но все же пока находится на стадии научных экспериментов.
•Боковой амиотрофический склероз является фатальным заболеванием. Средняя продолжительность жизни больных БАС 3 – 5 лет, тем не менее, 30% больных живут 5 лет, а около 10 – 20% живут более 10 лет от начала заболевания.
•Неблагоприятные прогностические признаки – пожилой возраст и бульбарные нарушения (после появления последних больные живут не более 1 – 3 лет).


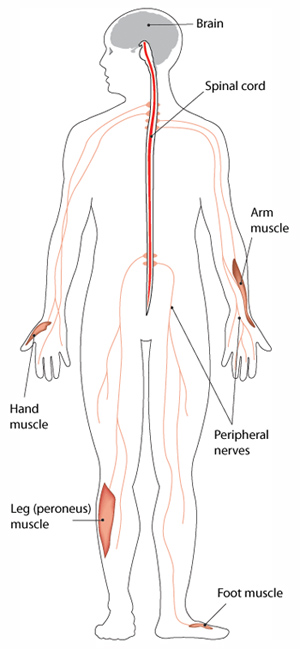 Что такое болезнь Шарко-Мари-Тута (БШМТ)?
Что такое болезнь Шарко-Мари-Тута (БШМТ)?
