Что такое болезнь диафрагмы
Что такое болезнь диафрагмы
Диафрагмальной грыжей называется перемещение органов брюшной полости в грудную полость через дефекты или слабые зоны диафрагмы.
Данные дефекты могут быть:
Релаксация диафрагмы (отсутствие сокращений диафрагмы) может наблюдаться вследствие различных нервно-воспалительных заболеваний, что приводит к растяжению диафрагмы и сдавлению легкого.
Симптомы
Пациенты с грыжами диафрагмы в большинстве случаев не предъявляют жалоб и грыжу обычно диагностируют при плановом обследовании по поводу другой патологии.
При больших размерах грыжи пациент может предъявлять жалобы на:
Причины развития грыж
Классификация грыж
Грыжи собственно диафрагмы
Грыжи естественных отверстий диафрагмы
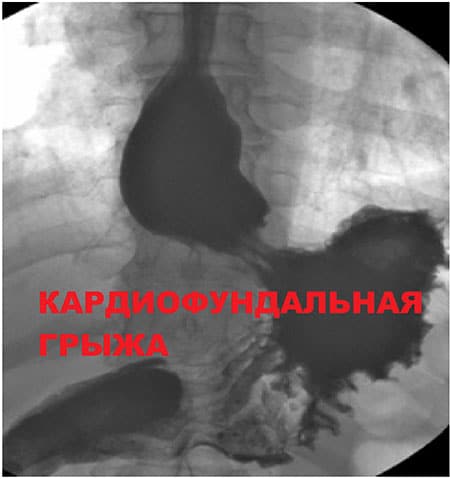
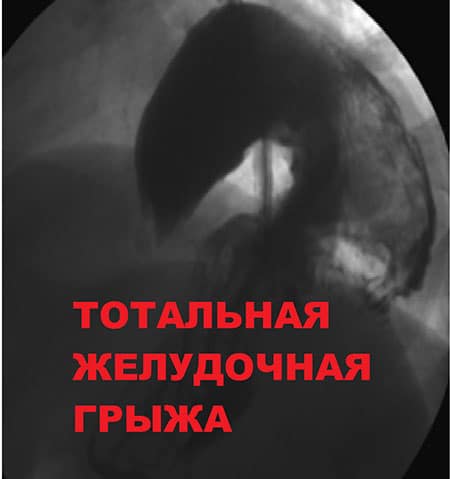
Грыжи диафрагмы на рентгене
Релаксация диафрагмы не относится к диафрагмальным грыжам, хотя истонченная диафрагма по существу является грыжевым мешком. Однако в настоящее время общепринято рассматривать релаксацию как самостоятельное заболевание, имеющее характерный симптомокомплекс и определенную патологоанатомическую сущность.
Травматические диафрагмальные грыжи в этиологии имеют отчетливый момент травмы. По существу это приобретенные грыжи. Они могут возникнуть после закрытых повреждений и в результате ранения. По наличию или отсутствию грыжевого мешка травматические диафрагмальные грыжи бывают истинными и ложными, а в зависимости от характера течения — острыми и хроническими, ущемленными и неущемленными.
Лечение
Лечение диафрагмальных грыж только хирургическое. Методик лечения существует огромное множество, однако результат лечения зависит от различных факторов, таких как:
Хирургическое лечение состоит в низведении органов брюшной полости и ушивании отверстия в диафрагме. С целью профилактики повторного возникновения грыжи на диафрагму устанавливается сетчатый протез.
Диета при грыжах диафрагмы
Рекомендуется исключить из рациона питания:
Питание должно быть дробное, 5 раз в день небольшими порциями. Нежелательно есть перед сном.
Лечение грыж диафрагмы в отделении торако — абдоминальной хирургии и онкологии РНЦХ
Хирургическое лечение грыж в в нашем отделении — это высококвалифицированные врачи, лучшее современное оборудование и внимательный персонал. Лечение предоставляется бесплатно в форматах оказания помощи по ОМС, ДМС, ВМП, а также на коммерческой основе. Узнайте подробности, как попасть на лечение в отделение торако-абдоминальной хирургии и онкологии РНЦХ им. акад. Петровского.
С клиническими случаями лечения грыж можно ознакомиться по ссылкам.
Для записи на консультацию позвоните по телефонам:
Отправьте заявку на консультацию, заполнив форму на нашем сайте и прикрепив необходимые документы.
Диафрагмальная грыжа с непроходимостью без гангрены (K44.0)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
2. Грыжи пищеводного отверстия диафрагмы.
3. Грыжи переднего отдела диафрагмы.
Классификация диафрагмальных грыж по этиологический принципу (Петровский Б.В. с соавт.)
1. Травматические грыжи.
2. Нетравматические грыжи:
2.1 Ложные врожденные грыжи.
2.2 Истинные грыжи слабых зон диафрагмы.
Классификация Жебровского В. В. и соавт. (2000)
1. Грыжи собственно диафрагмы:
3. Смешанный вариант, сочетающий аксиальную и параэзофагеальную грыжи.
Классификация ущемлений
Этиология и патогенез
Ущемление встречается при всех типах диафрагмальных грыж, кроме скользящих грыж пищеводного отверстия диафрагмы.
Ущемление может появиться как следствие имевшихся до этого симптомов диафрагмальной грыжи, так и на фоне полного здоровья. Вслед за ущемлением появляется механическое препятствие проходимости пищеварительного тракта с характерной картиной непроходимости (см. раздел «Краткое описание»), а также развивается ишемия ущемленных в грыжевом мешке органов.
Чаще всего ущемляются поперечная ободочная или тонкая кишка. Петли приводящего участка кишки при этом бывают сильно раздуты и переполнены токсическим содержимым.
Эпидемиология
Возраст: преимущественно пожилые
Признак распространенности: Редко
Факторы и группы риска
Клиническая картина
Клинические критерии диагностики
Cимптомы, течение
При ущемлении кишечника развивается картина странгуляционной непроходимости (рвота, схваткообразная боль и т.д.).
Краевое ущемление желудка отличается тем, что в начале приступа возникает рвота желудочным содержимым, после чего в рвотных массах появляется примесь желчи, а затем, зачастую, кровь.
Диагностика
Лабораторная диагностика
2. Общий анализ мочи:
— повышение удельного веса, цвета;
— снижение темпа диуреза;
— возможно умеренное повышение уровня индикана (редко).
3. Биохимия:
— нарушения электролитного состава (гипохлоремия, гипокалиемия) и гипопротеинемия могут отчасти маскироваться гемоконцентрацией;
— возможна небольшая гиперазотемия (редко);
— повышение уровня С-реактивного белка;
— повышение уровня молочной кислоты (гиперлактатемия, лактатацидоз) свидетельствует об ишемии стенки кишечника, при этом снижение уровня лактата в динамике (в том числе и после оперативного лечения) не означает отсутствия ишемии стенки кишечника.
Нарушение функции диафрагмы. Часть II. Диагноз. Лечение
Дисфункция диафрагмы ведет к дыхательной недостаточности. В последние годы к роли нарушения функции диафрагмы в критических ситуациях приковано пристальное внимание. Освежающая информация по проблеме представлена McCool F.D., Tzelepis G.E. в высокорейтинговом журнале (1). Приведенные данные в большей степени направлены на подготовку врача общей практики. Тем не менее, в силу отсутствия освежающей информации по данной проблеме, сфокусированной именно на анестезиолога и интенсивиста, рассматриваемые McCool F.D., Tzelepis G.E. аспекты представляют интерес. Основные положения работы следующие.
Диафрагма – куполообразная структура, отделяющая грудную и брюшную полость. Является основной мышцей, обеспечивающей дыхание. Иннервируется диафрагмальным нервом, который берет свое начало на уровне С3–С5 шейного отдела спинного мозга. Диафрагма преимущественно состоит из устойчивых к утомлению медленных мышечных волокон типа I и быстрых мышечных волокон типа IIа.
Диагноз
В случае возникновения подозрения на дисфункцию диафрагмы ее можно подтвердить различными методами. При рентгенографии грудной клетки возможно выявления приподнятой гемидиафрагмы и базальные субсегментарные ателектазы. Но подъем обеих гемидиафрагм (что обычно наблюдается у пациентов с зависимостью от респиратора) может интерпретироваться как “недостаточное усилие на вдохе” или “малый легочной объем” и характеризуется низкой специфичностью для постановки диагноза дисфункции диафрагмы. Хотя рентгенография грудной клетки является в достаточной степени чувствительным методом выявления одностороннего паралича диафрагмы (90%), ее специфичность неприемлемо мала (44%).
Рентгеноскопия диафрагмы широко используется для анализа функции диафрагмы. “Проба чиханием” заключается в исследовании движения диафрагмы во время короткого быстрого инспираторного усилия через нос. У пациентов без расстройства будет наблюдаться смещение диафрагмы книзу. При одностороннем параличе диафрагмы имеет место парадоксальное (в сторону головы) смещение парализованной диафрагмы. Хотя проба чиханием может использоваться для постановки диагноза одностороннего паралича диафрагмы, тест в настоящее время не рассматривается как диагностически эффективный при двухстороннем параличе. Ложно положительный результат пробы чиханием может иметь место у 6% пациентов без паралича диафрагмы и более. Ложно отрицательный результат может формироваться при активном сокращении мышц брюшной стенки во время выдоха с уменьшением объема менее функциональной остаточной емкости с последующей быстрой релаксацией мышц брюшной стенки в момент формирования вдоха, что приводит к каудальному смещению парализованной диафрагмы. Такое внезапное каудальное смещение в момент вдоха может ложно интерпретироваться как сокращение диафрагмы.
Решение об отработке версий, в целом, формируется с учетом инвазивности и доступности метода (рис. 1). Методы исследования функции легких, особенно регистрация жизненной емкости в вертикальном положении и положении лежа на спине, неинвазивны. При одностороннем параличе диафрагмы общая емкость легких может быть умеренно уменьшена (70–79% предполагаемого значения). При слабости диафрагмы тяжелой степени или двухстороннем параличе обычно имеет место уменьшение средней и тяжелой степени (30–50% предполагаемого значения общей емкости легких). Как при одностороннем, так двухстороннем параличе диафрагмы, рестриктивная дисфункция становится более выраженной в положении пациента лежа на спине. Уменьшение жизненной емкости на 30–50% при расположении пациента лежа на спине подтверждает диагноз двухстороннего паралича диафрагмы, тогда как уменьшение жизненной емкости на 10–30% от таковой в положении пациента сидя может наблюдаться при умеренной слабости диафрагмы или одностороннем ее параличе. При умеренном или отсутствии уменьшении жизненной емкости в положении лежа на спине наличие клинически значимой слабости диафрагмы маловероятно. Механизм уменьшения жизненной емкости в положении лежа на спине связан с ростральным смещением содержимого брюшной полости на фоне неэффективной активности дополнительных мышц вдоха. Функциональная остаточная емкость и остаточный объем обычно в норме у пациентов с односторонним параличом диафрагмы и уменьшены – при двухстороннем параличе.
Двумя дополнительными показателями силы диафрагмы являются максимальное статическое давление вдоха и давление вдоха при назальном чихании. Данные показатели также получают неинвазивным методом, но при их исследовании необходимо приложить усилия и они характеризуются большей изменчивостью, чем показатели дыхательного объема. Максимальное статическое давление вдоха и давление вдоха при назальном чихании снижены умеренно (примерно до 60% от предполагаемого значения) у пациентов с односторонним параличом диафрагмы и в значительной степени (до 30% и менее от предполагаемого значения) – при двухстороннем параличе. Максимальное давление выдоха у пациентов с заболеванием, затрагивающим диафрагму, обычно находится в пределах нормы, но за счет мышц выдоха. Одновременное уменьшение максимального статического давления вдоха и максимального давления выдоха предполагает, что причиной диафрагмальной дисфункции является генерализованный процесс, затрагивающий и мышцы вдоха, и мышцы выдоха (например, мышечная дистрофия). Умеренное уменьшение максимального давления выдоха (70–80% от предполагаемого значения) может просто отражать субоптимальные взаимоотношения длина-напряжение мышц выдоха при ограничении легочной емкости, а не генерализованную миопатию.
Непосредственные показатели функции диафрагмы можно классифицировать на получаемые инвазивным путем (например, трансдиафрагмальное давление [Pdi]) и неинвазивным путем (например, с помощью ультразвукового исследования). Эти показатели в некоторых лечебных учреждениях могут быть недоступными, но потребность в них может появляться при неопределенности диагноза. Для регистрации Pdi необходимо трансназальное введение баллонного катетера в нижний отдел пищевода и желудок. Pdi рассчитывают как разницу между давлением в желудке и пищеводе. Показатель может быть зарегистрирован во время обычного дыхания, максимального чихания (Pdi при чихании), максимальных дыхательных усилий при закрытой глотке (Pdi максимальное), транскожной электрической или магнитной стимуляции диафрагмального нерва (Pdi раздражения). Pdi при чихании и Pdi максимальное более 80 см вод. ст. у мужчин и более 70 см вод. ст. у женщин исключают клинически значимую слабость диафрагмы. Pdi раздражения более 10 см вод.ст. при односторонней стимуляции диафрагмального нерва или более 20 см вод.ст. – при двухсторонней также исключают клинически значимую слабость. Pdi раздражения является приемлемым показателем функции диафрагмы в случаях невозможности выполнения приемов, необходимых для регистрации иных вариантов Pdi, или при потребности в определении функции каждой гемидиафрагмы по отдельности. Хотя регистрация Pdi, в целом, рассматривается как стандарт для постановки диагноза билатерального паралича диафрагмы, метод инвазивен и вызывает дискомфорт.
Ультразвуковой анализ диафрагмы в месте соединения с реберной клеткой является неинвазивным методом, который может быть использован для регистрации изменений толщины диафрагмы во время вдоха. Утолщение диафрагмы отражает ее сокращение, отсутствие во время вдоха – является методом диагностики паралича диафрагмы. Поскольку ультразвуковой анализ позволяет разграничить функционирующую диафрагму от нефункционирующей, он может использоваться для диагноза и одностороннего, и двухстороннего паралича диафрагмы, а также для мониторинга восстановления функции парализованной диафрагмы. Опубликованы данные об ультразвуковом исследовании купола диафрагмы как методе документирования паралича диафрагмы у взрослых и детей. Но этот метод в первую очередь направлен на визуализацию центральной части диафрагмы, а не мышечного компонента, имеет ограничения, аналогичные таковым при рентгеноскопии диафрагмы.
Во время спокойного дыхания и во время стимуляции диафрагмального нерва может быть использована электромиография. Ее роль в диагностике паралича диафрагмы или ее слабости ограничивается множеством технических аспектов, включая правильное расположение электродов, возможность электромиографического перекрестного ответа от рядом располагающихся мышц, непостоянство расстояния между мышцами и электродами, что является следствием разницы в размере подкожного жирового слоя у различных больных. Но электромиография диафрагмы может принести пользу в разграничении нейропатической и миопатической причин известной дисфункции диафрагмы.
Лечение
Терапия пациентов с дисфункцией диафрагмы зависит от причины и наличия или отсутствия соответствующей клиники и ночной гиповентиляции. Примерами поддающихся терапии причин дисфункции диафрагмы являются миопатии, связанные с метаболическими нарушениями (такими как гипокалиемия, гипомагниемия, гипокальциемия, гипофосфатемия). Коррекция электролитов и гормональных нарушений, исключение применения мышечных релаксантов и препаратов, влияющих на нервную проводимость, может способствовать восстановлению силы диафрагмы. При миопатиях в связи паразитарными инфекциями (например, трихинеллезом) могут применяться соответствующие антимикробные препараты. В случаях идиопатического диафрагмального паралича или паралича в связи с невралгической амиотрофией может наступать спонтанное восстановление. При сохранении дисфункции диафрагмы или ее прогрессировании может потребоваться различной степени респираторная поддержка. Общепринятыми показаниями начала неинвазивной респираторной поддержки в ночное время являются РаСО2 45 мм рт.ст. и выше в дневное время, SaO2 88% и менее в течение 5 последовательных минут в ночное время, прогрессирующее нейромышечное заболевание с максимальным статическим давлением вдоха менее 60 см вод.ст. или форсированная жизненная емкость менее 50% предполагаемого значения.
Формирование складок диафрагмы является вмешательством, при котором к ослабленной части гемидиафрагмы подшивается мембранозная центральная часть и мышечный компонент диафрагмы. Показания и временные интервалы выполнения данного вмешательства полностью не определены (большинство исследований ретроспективны и неконтролируемы). Но вопрос о вмешательстве может быть рассмотрен у пациентов с односторонним параличом диафрагмы и выраженным диспноэ, кашлем, болью в грудной клетке или зависимостью от респиратора. Вмешательство может вести к приросту до 20% жизненной емкости, форсированного объема выдоха на 1 сек, общей емкости легкости на фоне улучшения клиники диспноэ. При этом уменьшается парадоксальное перемещение диафрагмы. В целом, до рекомендации вмешательства следует рекомендовать длительный период наблюдения. Это особенно справедливо для пациентов с односторонним параличом диафрагмы после кардиохирургических операций или иных хирургических операций на шее или средостении, поскольку функция диафрагмального нерва с течением времени может восстанавливаться. Морбидное ожирение и прогрессирующие нейромышечные заболевания являются относительными противопоказаниями для вмешательства. Эффект маловероятен при двухстороннем параличе диафрагмы.
Электростимуляция диафрагмального нерва может быть эффективной у пациента с зависимостью от респиратора на фоне двухстороннего паралича диафрагмы и интактных диафрагмальных нервов. Кандидатами для этого метода терапии является в первую очередь пациенты с высоко шейной тетраплегией или пациенты с гиповентиляцией центрального генеза. Несмотря на техническое усовершенствование систем для стимуляции диафрагмального нерва, активация диафрагмы не обеспечивает устойчивого эффекта с полной поддержкой функции внешнего дыхания. Опубликованы обещающие данные при использовании более новых методов с лапароскопическим расположением электродов для стимуляции диафрагмы.
У пациентов с дисфункцией диафрагмы часто встречаются расстройства дыхания во время сна: подавление активности дополнительных мышц вдоха во время быстрой фазы сна ведет к гиповентиляции. У пациентов с выраженной слабостью диафрагмы или односторонним параличом диафрагмы расстройства дыхания во время сна формируются независимо от индекса массы тела, пола и возраста. У больных со слабостью диафрагмы в связи с нейромышечным заболеванием, таким как мышечная дистрофия или боковой амиотрофический склероз, могут иметь место обструктивное апноэ во время сна. Слабость мышц глотки и гортани в таких случаях может предрасполагать пациентов к коллапсу дыхательных путей во время вдоха. Как и при других случаях расстройств дыхания во время сна, предпочтительным методом терапии пациентов с параличом диафрагмы является неинвазивная ИВЛ.
Пороки развития диафрагмы у новорожденных
Общая информация
Краткое описание
Эмбриология. Диафрагма формируется из 4-х различных структур-поперечной перегородки, дорсальной пищеводной брыжейки, плевроперитонеального канала и межреберных мышц. В результате нарушения процесса закрытия плевроперитонеального канала на 8-10 неделе беременности возникает дефект диафрагмы. Органы брюшной полости могут эвентрировать через дефект в плевральную полость в течение всего периода после возращения кишечника в брюшную полость (9-10 недель гестации).[2]
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
• Консультация клинического фармаколога
Изменений в лабораторных анализах, специфичных для данного порока как правило, не бывают.
Сочетание с пороками развития других органов и систем до 50%, из них 20%- врожденные пороки сердца, 10,7%- пороки Ц.НС. и мочевыделительной системы, 10-12% являются составной частью различных наследственных синдромов (пентадаКантрелла, синдром Фринсе де Ланге и др). Частота хромосомных аномалий в среднем составляет 16%.
Для прогноза заболевания необходимо определение фракции выброса и массы миокарда левого желудочка. Важна также оценка степени развития легочных артерий с помощью индекса Nakata или модифицированного индекса McGoon (отношение суммы диаметров правой и левой легочных артерий к диаметру нисходящей аорты на уровне диафрагмы), так как отмечено, что при индексе менее 1,3 летальность среди пациентов достигает 100%.
Дифференциальный диагноз
| Ложная диафрагмальная грыжа | КАМЛ | Опухоль средостения (нейробластома) | Легочная секвестрация | Бронхогенная киста | Врожденная лобарная эмфизема |
| При даче контрастного вещества орально, через 2-3 часа позволяют выявить месторасположения петель кишечника. | В зоне поражения тонкостенные воздушные кисты. | Тень (анэхогенная) с четкими контурами с локализацией в переднем или заднем средостении | Отсутствие анэхогенного образования в структуре пораженного участка | Изолированное анэхогенное образование в структуре лёгкого, не сопровождающей повышение эхогенности окружающей ткани | Перерастяжение легочной паренхимы без деструкции |
Лечение
Цель лечения: нормализация функции сердечно-легочной системы и погружение органов в брюшную полость с восстановлением целостности диафрагмы.
• Сократить до минимума все инвазивные и другие процедуры, связанные с внешним воздействием на ребенка (санацию трахеи и др.), так как они могут спровоцировать легочную вазоконстрикцию
MAP- среднее давление в дыхательных путях
— осуществление инфузионной терапии, введение инотропных и вазоактивных, седативных препаратов (смотрите ниже)
• Ингаляция оксида азота [4,9] используется для снижения легочного сосудистого сопротивления пациентов, которые плохо отвечают на механическую вентиляцию легких и заместительную терапию сурфактантом. Молекула оксида азота NO продуцируется эндогенно при взаимодействии фермента нитроксидсинтетазы и аргинина, что ведет к вазодилатации. Ингаляция оксида азота позволяет достичь селективнойвазодилатации сосудов легких. Доза iNO подбирается от 1 до 20 ppm до получения клинического эффекта. Продолжительность не более 7 сут. При положительном эффекте (улучшение оксигенации и степени легочной гипертензии) концентрацию NO снижают ступенчато до 5 ppmв первые 4-6 часов. Далее снижение на 1ppm медленно, в течении 1-5 сут. критериями отмены ингаляции NO является РаО2 более 50-60 мм.рт.ст. при FiO2 менее 0,6 и концентрация NO, равной 1ppm в течении 60 мин.Перед разъединением с контурам пациента необходимо увеличить FiO2 на 10-15%.При ингаляции оксид азота возможно образование метгемоглобина: его уровень в крови не должен превышать 2,5%. (D)
Опухоли средостения: что это такое, классификация.
Опухоли средостения – общее название новообразований, которые расположены в медиастинальном пространстве груди. В 40% случаев диагностирования опухоли являются злокачественными, и тогда ставится диагноз рак средостения. Все опухоли делятся на две большие группы – первичные и вторичные. В первом случае речь идет о тех новообразованиях, которые формируются непосредственно в области средостения, во втором – опухоли образуются сначала в тканях, расположенных вне обозначенной области, а рак средостения развивается уже из метастаз. Иногда опухоли средостения называют рак тимуса, но это не совсем корректное обозначение диагноза. Дело в том, что он обозначает наличие злокачественных клеток в вилочковой железе, тогда как опухоли средостения могут начать свой рост и из других структур.
В зависимости от локализации опухоли различают следующие виды злокачественных новообразований:
Злокачественные новообразования средостения диагностируются чаще всего в возрасте 18-45 лет, какой-то гендерной предрасположенности не отмечается.
Отдельно в медицине рассматриваются мезенхимальные опухоли – представляют собой рак мягких тканей, к таковым относятся липомы и гемангиомы, лейомиосаркомы и фибромы. Поражают разные части средостения, относятся к группе вторичных, потому что «вырастают» из метастаз.
К редким опухолям средостения относятся липо- и фибросаркомы. Их опасность заключается в том, что они долгое время протекают бессимптомно и пациент обращается за помощью к врачу при выраженных нарушениях, когда рак находится уже на 3 и 4 стадии развития. Также к этой группе относится рак тимуса (тимома) – развивается в клетках вилочковой железы.
Какие симптомы укажут на рак средостения?
Рак может протекать в двух стадиях – бессимптомной и с выраженными признаками. Продолжительность прогрессирования опухоли средостения без симптомов зависит от нескольких факторов – место локализации новообразования, уровень общего иммунитета, возраст человека. Часто бессимптомно протекающий рак диагностируется случайно, во время проведения стандартной процедуры флюорографии в рамках диспансеризации.
К основным признакам рака средостения относятся:
Злокачественные опухоли растут достаточно быстро, поэтому переход из бессимптомной стадии в форму с выраженной клинической картиной недолгий. Могут проявляться и дополнительные симптомы типа отечности верхней части туловища и лица, синюшного цвета лица, расширения подкожных вен шеи.
Самым ранним проявлением рака средостения считается болевой синдром, особенно часто он проявляется при раке тимуса. В таком случае боли идентичны приступам стенокардии. Существует и ряд специфичных признаков опухолей средостения:
Общие симптомы, слабовыраженная клиническая картина, многообразие признаков, которые присущи и другим патологиям, делают диагностику только по жалобам пациента и стандартным обследованиям практически невозможной. Кроме этого, опухоли средостения могут быть и доброкачественными – например, рак тимуса по своей клинической картине полностью идентичен признакам доброкачественных новообразований в вилочковой железе.
Диагностика опухоли средостения.
Опухоль средостения может быть диагностирован инструментальными методами, которые являются самыми информативными:
Если перечисленных обследований недостаточно, то назначается хирургическая биопсия. Морфологическое исследование биологического материала позволяет полностью охарактеризовать рак средостения. Эта манипуляция важна для классификации опухоли – будет ли диагностирован именно рак тимуса или опухоль представляет собой доброкачественное образование.
Если есть подозрение на тимому (рак тимуса), то целесообразно проводить ультразвуковое исследование. Оно не выявит опухоль средостения, но даст возможность оценить состояние лимфатических узлов и жировой ткани в подключичной области.
К общим методам диагностики относятся анализы крови (общий, биохимический, коагулограмма), анализ мочи (общий), ЭКГ.
Лечение опухолей средостения.
Самым эффективным методом лечения опухолей средостения считается его хирургическое удаление, которое всегда сопровождается и специфической терапией. Если диагноз был поставлен на ранней стадии, врач может четко определить размер и форму опухоли, то применяется радиохирургический метод ее удаления по системе КиберНож. В случае больших размеров опухоли средостения удаляются классическим хирургическим методом с последующей химиотерапией. Диагностирование рака на поздней стадии делает нецелесообразным оперативное удаление новообразования, поэтому пациенту назначают только поддерживающее лечение (химиотерапия или лучевая) – рак средостения прекращает стремительно разрастаться, снижается вероятность распространения метастаз, облегчается симптоматика.
Если диагностирован рак тимуса (тимома), то врач опирается на данные исследований – каков размер опухоли средостения, есть ли ее разрастание. В некоторых случаях сначала проводится несколько курсов химиотерапии и только после этого назначается хирургическое лечение. Дополнительно, после проведения операции по удалению опухоли средостения, пациенту назначают гормональные препараты, иммуноподдерживающие средства.
Принимать решение о проведении терапевтического лечения или хирургического удаления опухоли средостения может только лечащий врач. Операция выполняется только в том случае, если специалист будет уверен в том, что он сможет удалить сразу все новообразование. Так как диагноз рак средостения часто ставится на поздних стадиях заболевания, то даже хирургические методы могут быть бесполезными по причине распространения метастаз, поражения внутренних органов и мягких тканей вокруг средостения.
Прогноз рака средостения.
Теоретически прогнозы на выздоровление при диагностировании опухоли средостения (рака тимуса) положительные. Но проблема заключается в сложностях диагностики – клиническая картина не типичная для злокачественных образований, часто люди либо предпринимают попытки лечения сами, либо обращаются со стандартными жалобами к врачу и им ставят неверный диагноз. Пока проводится лечение неверного заболевания, время проходит и наступает рак, средостения достигает тяжелой стадии. При своевременном выявлении рака тимуса вероятность благоприятного исхода составляет 68%.
Опухоли средостения (рак тимуса) возможно вылечить, но при условии своевременного выявления. Хирургический метод и последующая химиотерапия дают возможность полностью выздороветь. По причине неспецифической клинической картины диагностирование на ранней стадии затруднено, поэтому важно проходит диспансеризацию – это реальный шанс полностью избавиться от злокачественных образований.
Филиалы и отделения, в которых лечат опухоль средостения (рак тимуса)
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
В Отделе торакоабдоминальной онкохирургии
Заведующий отделом – д.м.н. А.Б. РЯБОВ
В Отделении торакальной хирургии
Контакты: (495) 150 11 22
МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Заведующий Отделом торакоабдоминальной онкологии – д.м.н. В.Ю. СКОРОПАД