Что такое бокаловидные клетки в эпителии
Бокаловидная клетка
Бокаловидные клетки (синонимы: энтероциты бокаловидные, бокаловидные экзокриноциты; лат. enterocytus caliciformis ) — продуцирующие слизь клетки эпителия слизистой оболочки кишечника и других органов позвоночных животных и человека. Бокаловидные клетки часто называют одноклеточными железами. [1]
Содержание
Локализация
Бокаловидные клетки — один из энтероцитов эпителия кишечника. Располагаются на кишечных ворсинках поодиночке среди каёмчатых энтероцитов. Обычно отсутствуют на самой вершине ворсинки, а также на дне крипты. В тонкой кишке человека составляют 9,5 % от всех клеток эпителиального пласта. Число бокаловидных клеток увеличивается в дистальном направлении кишки. [2]
Кроме кишечника, бокаловидные клетки имеются в слизистой оболочке дыхательных путей, в конъюнктиве глаз, протоках поджелудочной и околоушных слюнных желёз. [3] В дыхательных путях больше всего бокаловидных клеток находится в экстраторакальной части трахеи, с уменьшением диаметра бронхов их количество существенно сокращается, а в бронхиолах менее 1 мм их нет совсем. [4]
Структура и функции
Бокаловидные клетки накапливают гранулы муциногена, которые, абсорбируя воду, набухают и превращаются в муцин (основной компонент слизи). При этом клетки обретают форму бокала, суженного у основания (где находится ядро) и округлой широкой в апикальной, верхней части. Затем набухшая верхняя часть бокаловидной клетки разрушается, слизь переходит в просвет органа, клетка приобретает призматическую форму и снова начинает накапливать муциноген. Слизь, выделяемая бокаловидными клетками, служит для увлажнения поверхности слизистой оболочки кишечника и этим способствует продвижению химуса, а также участвует в процессах пристеночного пищеварения.
Апикальная часть бокаловидных клеток имеет исчерченную каёмку, подобно каёмчатым энтероцитам. Однако, в отличие от каёмчатых энтероцитов, микроворсинки каёмки у бокаловидных клеток расположены реже и неодинаковы по высоте. [2]
Метаплазия бокаловидных клеток
При некоторых патологиях бокаловидные клетки могут встречаться в тканях и органах, в которых в норме они или отсутствуют, или присутствуют в значительно меньшем количестве. Часто такая метаплазия является предраковым состоянием. Так, при пищеводе Барретта, осложнении гастроэзофагеальной рефлюксной болезни, рассматриваемом как предраковое состояние пищевода, бокаловидные клетки обнаруживаются в пищеводе. [5]
Наличие бокаловидных клеток в слизистой оболочке желудка считается важнейшим диагностическим признаком кишечной метаплазии (состояние предрака желудка). [6]
Гиперплазия бокаловидных клеток дыхательных путей с переходом в метаплазию и дисплазию или без является патологическим состоянием — предшественником рака лёгких. [7]
Функциональная морфология бокаловидных клеток тонкой кишки при действии различных факторов
Полный текст:
Аннотация
Желудочно-кишечный тракт постоянно подвергается воздействию различных физических и химических факторов. В кишечнике контакт бактерий с эпителиоцитами в значительной степени зависит от слизи, которая в основном состоит из высоко гликозилированного муцина-2, секретируемого бокаловидными клетками эпителия слизистой. Бокаловидные клетки располагаются по всей длине тонкой и толстой кишки и отвечают за выработку и поддержание защитного слоя слизи путем синтеза и секрециивысоко-молекулярных гликопротеинов, известных как муцины. В статье представлены данные об эмбриогенезе тонкой кишки в целом и, бокаловидных клеток, в частности; представлен литературный обзор, раскрывающий роль бокаловидных клеток в морфофункциональной организации кишечного тракта и функциональной активности их секрета. Ввиду особенностей этих сильно поляризованных экзокринных клеток обсуждаются клеточные механизмы, с помощью которых бокаловидные клетки секретируют свои продукты.
Ключевые слова
Об авторах
Шарапов Илья Юрьевич
ул. Студенческая, 10, Воронеж, 394036
Список литературы
1. Афанасьев Ю.И., Юрина Н.А. Гистология. М.: Медицина; 1983
2. Ачасова К.М., Литвинова Е.А., Кожевникова Е.Н. Роль компонентов муцина-2 в изменении состава нормальной микрофлоры кишечника и мукозального иммунитета мышей. Russian Scientist. 2017;1(2):8–9
3. Бахтин А.А. Особености гистохимических показателей в тонкой кишке при воздействии неблагоприятных экологических факторов. Современные проблемы науки и образования. 2012;1:18
4. Бахтин А.А., Наумова Л.И. Морфологическая характеристика стенки тонкой кишки при воздействии сероводородсодержащего газа. Астраханский медицинский журнал. 2012;7(4):37–40
5. Воробьев А.А., Несвижский Ю.В., Липницкий Е.М. и др. Микробное сообщество пристеночного муцина различных отделов желудочно-кишечного тракта человека. Вестник РАМН. 2004;(4):23–8
6. Давлатова И.С., Наумова Л.И., Шишкина Т.А.Реактивность кишечного эпителия на фоне действия гипоксии разного генеза. Актуальные вопросы современной медицины: Материалы IV международной научно-практической конференции прикаспийских государств. Астра-хань. 2019; 274–6 [Davlatova IS, Naumova LI,
7. Могильная Г.М., Пейливаньян Э.Г. Синтез муцинов бокаловидными гландулоцитами двенадцатиперстной кишки на различных этапах онтогенеза. Астраханский медицинский журнал. 2013;8(1):158–60
8. Симаненков В.И., Маев И.В., Ткачева О.Н., Алексеенко С.А., Андреев Д.Н., и др. Синдром повышенной эпителиальной проницаемости в клинической практике. Мультидисциплинарный национальный консенсус. Кардиоваскулярная терапия и профилактика. 2021;20(1):2758 [
9. Al Alam D, Danopoulos S, Schall K, Sala FG, Almohazey D, Fernandez GE, et al. Fibroblast growth factor 10 alters the balance between goblet and Paneth cells in the adult mouse small intestine. American Journal of PhysiologyGastrointestinal and Liver Physiology. 2015 Apr 15;308(8):G678–90. doi: 10.1152/ajpgi.00158.2014
10. Becciolini A, Fabbrica D, Cremonini D, Balzi M.Quantitative Changes in the Goblet Cells of the Rat Small Intestine after Irradiation. Acta Radiologica: Oncology. 1985 Jan;24(3):291–9. doi: 10.3109/02841868509134403
11. Birchenough GMH, Johansson ME, Gustafsson JK, Bergström JH, Hansson GC. New developments in goblet cell mucus secretion and function. Mucosal Immunology. 2015 Apr 15;8(4):712–9. doi: 10.1038/mi.2015.32
12. Boshuizen JA, Reimerink JHJ, Korteland-van Male AM, van Ham VJJ, Bouma J, Gerwig GJ, et al.Homeostasis and function of goblet cells during rotavirus infection in mice. Virology. 2005 Jul;337(2):210–21. doi: 10.1016/j.virol.2005.03.039
13. Calvert R, Bordeleau G, Grondin G, Vezina A, Ferrari J.On the presence of intermediate cells in the small intestine. The Anatomical Record. 1988 Mar;220(3):291–5. doi: 10.1002/ar.1092200310
14. Chairatana P, Nolan EM. Defensins, lectins, mucins, and secretory immunoglobulin A: microbe-binding biomolecules that contribute to mucosal immunity in the human gut. Crit Rev Biochem Mol Biol. 2017;52(1):45-56. doi:10.1080/10409238.2016. 1243654
15. Collins P. Development of midgut. 39th edn. Gray’s anatomy. Standring S, Ellis H, Healy JC, et al. London, Churchill Livingstone, 2005:1256-9.
16. Dharmani P, Srivastava V, Kissoon-Singh V, et al.Role of intestinal mucins in innate host defense mechanisms against pathogens. J Innate Immun 2009;1(2):123–35.
17. Eroschenko VP. diFiore’s atlas of histology with functional correlations. 11th edn. Lippincott Williams and Wilkins, 2005:341-2.
18. Forder REA, Howarth GS, Tivey DR, Hughes RJ.Bacterial Modulation of Small Intestinal Goblet Cells and Mucin Composition During Early Posthatch Development of Poultry. Poultry Science. 2007 Nov;86(11):2396–403. doi: 10.3382/ps.2007-00222
19. Gomes JR, Ayub LC, dos Reis CA, Machado MJ, da Silva J, Omar NF, et al.Goblet cells and intestinal Alkaline phosphatase expression (IAP) du ring the development of the rat small intestine.Acta Histochemica. 2017 Jan;119(1):71–7. doi: 10.1016/j.acthis.2016.11.010
20. Johansson ME, Phillipson M, Petersson J, Velcich A, Holm L, Hansson GC.The inner of the two Muc2 mucin-dependent mucus layers in colon is devoid ofbacteria. Proc Natl Acad Sci USA. 2008;105:15064–15069.
21. Karam SM.Lineage commitment and maturation of epithelial cells in the gut. Front Biosci 1999;4:D286–98
22. Kishida K, Pearce SC, Yu S, Gao N, Ferraris RP.Nutrient sensing by absorptive and secretory progenies of small intestinal stem cells. American Journal of Physiology-Gastrointestinal and Liver Physiology. 2017 Jun 1;312(6):G592–605. doi: 10.1152/ajpgi.00416.2016
23. Lang T, Klasson S, Larsson E, Johansson MEV, Hansson GC, Samuelsson T.Searching the Evolutionary Origin of Epithelial Mucus Protein Components—Mucins and FCGBP. Molecular Biology and Evolution. 2016 Apr 4;33(8):1921–36
24. Larsen WJ. Development of the gastrointestinal tract. Human embryology. 2nd edn. New York. Churchill Livingstone; 1997:245–8.
25. Lei W, Ren W, Ohmoto M, Urban JF, Matsumoto I, Margolskee RF, et al.Activation of intestinal tuft cell-expressed Sucnr1 triggers type 2 immunity in the mouse small intestine. Proceedings of the National Academy of Sciences. 2018 May 7;115(21):5552–7. doi: 10.1073/pnas.1720758115
26. Levin DE, Barthel ER, Speer AL, Sala FG, Hou X, Torashima Y, et al. Human tissue-engineered small intestine forms from postnatal progenitor cells. Journal of Pediatric Surgery. 2013 Jan;48(1):129–37. doi: 10.1016/j.jpedsurg.2012.10.029
27. Lievin-Le Moal V, Servin AL. The front line of enteric host defense against unwelcome intrusion of harmful microorganisms: mucins, antimicrobial peptides, and microbiota. Clin Microbiol Rev2006;19(2):315–37.
28. Liu SP, Chang CY, Huang WH, Fu YS, Chao D, Huang HT.Dimethylthiourea pretreatment inhibits endotoxin-induced compound exocytosis in goblet cells and plasma leakage of rat small intestine. Journal of Electron Microscopy. 2009 Oct 12;59(2):127–39. doi: 10.1093/jmicro/dfp049
29. Merzel J, Leblond CP.Origin and renewal of goblet cells in the epithelium of the mouse small intestine. American Journal of Anatomy. 1969 Mar;124(3):281–305. doi: 10.1002/aja.1001240303
30. Middendorp S, Schneeberger K, Wiegerinck CL, Mokry M, Akkerman RDL, van Wijngaarden S, et al.Adult Stem Cells in the Small Intestine Are Intrinsically Programmed with Their LocationSpecific Function. STEM CELLS. 2014 Apr 17;32(5):1083–91. doi: 10.1002/stem.1655
31. Pelaseyed T, Bergström JH, Gustafsson JK, Ermund A, Birchenough GMH, Schütte A, et al.The mucus and mucins of the goblet cells and enterocytes provide the first defense line of the gastrointestinal tract and interact with the immune system. Immunological reviews. 2014;260(1):8–20. doi: 10.1111/imr.12182
32. Pfoze K, Rajshree H.Time of appearance of goblet cells in human small intestine. Journal of Evolution of Medical and Dental Sciences. 2018 Apr 23;7(17):2099–103. doi: 10.14260/jemds/2018/470
33. Rojanapo W, Lamb AJ, Olson JA.The Prevalence, Metabolism and Migration of Goblet Cells in Rat Intestine following the Induction of Rapid, Synchronous Vitamin A Deficiency. The Journal of Nutrition. 1980 Jan 1;110(1):178–88. doi: 10.1093/jn/110.1.178
34. Rubio CA.Paneth cells and goblet cells express the neuroendocrine peptide synaptophysin. I. Normal duodenal mucosa. In Vivo. 2012 JanFeb;26(1):135-8.
35. Salim SY, Söderholm JD.Importance of disrupted intestinal barrier in inflammatory bowel diseases. Inflamm Bowel Dis. 2011;17(1):362-81.
36. Specian RD, Oliver MG. Functional biology of intestinal goblet cells. The American journal of physiology. 1991;260(2 Pt 1):C183-93. doi: 10.1152/ajpcell.1991.260.2.C183
37. van Es JH, van Gijn ME, Riccio O, van den Born M, Vooijs M, Begthel H, et al. Notch/γ-secretase inhibition turns proliferative cells in intestinal crypts and adenomas into goblet cells. Nature. 2005 Jun;435(7044):959–63. doi: 10.1038/nature03659
38. Verburg M, Renes IB, Meijer HP, Taminiau JAJM, Büller HA, Einerhand AWC, et al. Selective sparing of goblet cells and Paneth cells in the intestine of methotrexate-treated rats. American Journal of Physiology-Gastrointestinal and Liver Physiology. 2000 Nov 1;279(5):G1037–47. doi: 10.1152/ajpgi.2000.279.5.G1037
39. von Moltke J, Ji M, Liang H-E, Locksley RM.Tuft-cell-derived IL-25 regulates an intestinal ILC2–epithelial response circuit. Nature. 2015 Dec 14;529(7585):221–5. doi: 10.1038/nature16161
40. Wang H, Liu J, Zhao W, Zhang Z, Li S, Li S, et al.Effect of Fluoride on Small Intestine Morphology and Serum Cytokine Contents in Rats. Biological Trace Element Research. 2018 Sep 13;189(2):511–8. doi: 10.1007/s12011-018-1503-y
41. Wang Y, Song W, Wang J, Wang T, Xiong X, Qi Z, et al. Single-cell transcriptome analysis reveals differential nutrient absorption functions in human intestine. Journal of Experimental Medicine. 2019 Nov 21;217(2) doi: 10.1084/jem.20191130
42. Wigley C. Microstructure of the small intestine. Gray’s anatomy. 39th edn. Standring S, Ellis H, Healy JC, et al. London, Churchill Livingstone, 2005:1157-69.
43. Ye DZ, Kaestner KH.Foxa1 and Foxa2 control the differentiation of goblet and enteroendocrine Land D-cells in mice. Gastroenterology. 2009 Dec 1;137(6):2052–62. doi: 10.1053/j.gastro.2009.08.059
Для цитирования:
Шарапов И.Ю., Кварацхелиия А.Г., Болгучева М.Б., Коротких К.Н. Функциональная морфология бокаловидных клеток тонкой кишки при действии различных факторов. Журнал анатомии и гистопатологии. 2021;10(2):73-79. https://doi.org/10.18499/2225-7357-2021-10-2-73-79
For citation:
Sharapov I.Yu., Kvaratskheliiya A.G., Bolgucheva M.B., Korotkikh K.N. Functional Morphology of Goblet Cells of the Small Intestine under the Influence of Various Factors. Journal of Anatomy and Histopathology. 2021;10(2):73-79. (In Russ.) https://doi.org/10.18499/2225-7357-2021-10-2-73-79
Бокаловидная клетка
Бокаловидная клетка (лат. enterocytus caliciformis) — секретирующая слизь клетка эпителия слизистой оболочки кишечника или другого органа. Также называется энтероцит бокаловидный, бокаловидный экзокриноцит или клетка гоблет.

На рисунке слева кишечная ворсинка человека, показанная в разрезе. Бокаловидные клетки в кишечной ворсинке обозначены литерой е.
Другими литерами отмечены:
а) базальная мембрана
b) лимфатический сосуд
с) цилиндрический эпителий
d) каёмка эпителиальных клеток
f) и f’) лимфоциты в эпителии и под эпителием
g) кровеносные сосуды
h) гладкомышечные волокна в поперечном разрезе.
Бокаловидные клетки располагаются на кишечных ворсинках поодиночке среди клеток каёмчатых. На вершинах кишечных ворсинок, а также на дне либеркюновых желёз (кишечных крипт) бокаловидные клетки чаще всего отсутствуют. В тонкой кишке человека бокаловидные клетки составляют 9,5 % от всех клеток эпителия. Число бокаловидных клеток увеличивается в дистальном направлении кишки.
Кроме кишечника, бокаловидные клетки имеются в слизистой оболочке дыхательных путей, в конъюнктиве глаз, протоках поджелудочной и околоушных слюнных желёз.
Бокаловидные клетки накапливаются гранулы муциногена, которые, абсорбируя воду, набухают и превращаются в муцин. Клетки обретают форму бокала, суженного у основания и широкого и округлого в верхней части. После чего набухшая верхняя часть бокаловидной клетки разрушается, слизь переходит в просвет органа, клетка приобретает призматическую форму и снова начинает накапливать муциноген. Слизь, выделяемая бокаловидными клетками, увлажнения поверхности слизистой оболочки кишечника и этим способствует продвижению химуса, а также участвует в процессах пристеночного пищеварения.
Направленная в просвет кишки часть бокаловидных клеток имеет исчерченную каёмку, подобно клеткам каёмчатым. Однако, в отличие от клеток каёмчатых, микроворсинки каёмки у бокаловидных клеток расположены реже и различны по высоте.
Особенности атрофических и дисрегенераторных изменений слизистой оболочки желудка у больных хроническим атрофическим гастритом различных возрастных групп
Клиника госпитальной терапии Военно-медицинской академии имени С.М. Кирова
Интерес исследователей к раннему раку желудка в значительной мере обусловлен тем, что он является своеобразной «переходной» формой между предраковыми изменениями слизистой оболочки желудка и развитым раком желудка, и его изучение позволяет точнее понять морфогенез опухоли и обосновать методы своевременной диагностики и профилактики [8].
Как показали исследования P. Correa, формирование интестинального рака желудка закономерно протекает через ряд последовательных дискретных морфологических стадий: неатрофический гастрит, атрофический гастрит, метаплазия эпителия кишечного типа, прогрессирующая дисплазия и рак insitu, завершающийся инвазивным раком (каскад Корреа). Указанный процесс охватывает обычно период от 20 до 30 лет [11].
Диагноз заболевания верифицировали на основании характерных жалоб, анамнеза, результатов объективного обследования, данных лабораторных и инструментальных исследований. Решающими в постановке окончательного диагноза были данные эзофагогастродуоденоскопии и морфологического исследования слизистой оболочки желудка.
В процессе эндоскопического исследования визуально оценивали наличие, выраженность, распространенность и локализацию воспалительной реакции, очагов атрофии. При воспалительных изменениях слизистой оболочки желудка наблюдали пятнистую гиперемию, отек, подслизистые кровоизлияния, гиперплазию складок. При атрофическом процессе наблюдали бледность, истонченность, повышенную ранимость, сглаженность слизистой оболочки в теле и антральном отделе желудка, просвечивание сосудов.
Прицельные биоптаты слизистой оболочки желудка, полученные при эндоскопическом исследовании, фиксировали в 10% растворе нейтрального формалина, обезвоживали, заливали в парафин, срезы толщиной в 5 мкм окрашивали гематоксилином и эозином и методом ШИК-реакции. Патоморфологические изменения слизистой оболочки желудка оценивали в соответствии с международной классификацией хронического гастрита (Dixon M. Et al., 1996). Оценку выраженности атрофического процесса, кишечной метаплазии и клеточной инфильтрации стромы слизистой оболочки проводили в соответствии с дополнениями к Сиднейской классификации.
Результаты. В работах различных авторов [3, 9, 10] неоднократно указывалась ценность эндоскопического метода исследования в возможности выполнения биопсии с последующим гистологическим исследованием полученного материала. Диагноз “хронический гастрит” должен быть исключительно клинико-морфологическим, а при постановке окончательного диагноза необходимо, прежде всего, ориентироваться на результаты гистологического анализа, поскольку данные эндоскопического и морфологического исследований нередко могут не совпадать. Однако часто в повседневной клинической практике врачи ориентируются только на данные эндоскопического исследования.
В нашем исследовании также проводился анализ эндоскопических и морфологических признаков атрофии слизистой оболочки желудка.
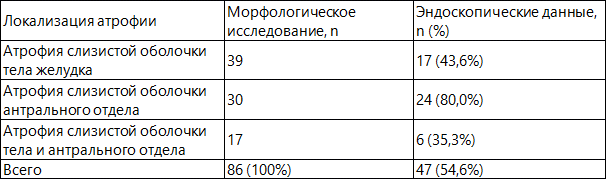
Данные по выявлению атрофических изменений слизистой оболочки желудка, полученные в процессе эндоскопического исследования, в сравнении с морфологическими данными представлены в табл. 1.
Таблица 1. Сравнительная оценка морфологических и эндоскопических данных в диагностике атрофии слизистой оболочки желудка.
Согласно полученным данным, можно утверждать, что при диагностике атрофических изменений слизистой оболочки желудка у больных хроническим гастритом в процессе эндоскопического исследования и морфологического анализа их результаты совпадают лишь в 54,6% случаев. Примерно у половины больных атрофические изменения слизистой оболочки желудка, выявленные морфологическим методом, остаются недоступными для адекватной эндоскопической оценки, что обосновывает необходимость гистологической верификации «гастритического» процесса.
Стало понятно, как возникает предраковое состояние пищевода — синдром Барретта
Рис. 1. Схематическое изображение эпителия в месте сочленения пищевода (Oesophagus) и желудка (Stomach), в котором встречаются эпителиальные клетки разных типов. Переходный эпителий (Transitional epithelium) образован базальными (Basal layer) и люминальными (Luminal layer) клетками, которые характеризуются различным уровнем экспрессии трех белков-маркеров (p63, KRT5 и KRT7). Рефлюкс, вызванный желчными кислотами, или нарушение экспрессии каких-то генов могут вызвать превращение эпителия пограничной области в аномальный — подобный эпителию кишечника — с включениями бокаловидных клеток (Goblet cell), и формируется разрастающаяся структура, называемая пищеводом Барретта (Barrett’s oesophagus). Рисунок из популярного синопсиса к обсуждаемой статье
Ученым удалось разобраться в механизме возникновения предракового состояния в месте соединения пищевода и желудка — синдрома Барретта. Они смогли детально охарактеризовать эпителий в этой пограничной области и на лабораторных мышах показали, что базальные клетки с определенным набором маркеров могут стать предшественниками ткани, подобной ткани кишечника, которая замещает нормальный эпителий этой области. Клетки со сходными свойствами найдены на границе пищевода и желудка и у человека, поэтому данное исследование должно помочь улучшить методы ранней диагностики и лечения онкологических заболеваний.
Хорошо известно, что чем раньше диагностировать и начать лечить рак, тем легче может быть само лечение и тем выше шансы на выздоровление. Для некоторых типов рака выявлены так называемые предраковые состояния — изменения тканей, которые сами по себе не являются злокачественными, но повышают вероятность развития рака в этих тканях. Такие состояния известны пока для относительно небольшого числа раков. Поэтому, с одной стороны, нужно пытаться расширять список соответствий между злокачественными опухолями и предраковыми состояниями, а с другой стороны — выяснять механизмы возникновения этих состояний, чтобы повышать эффективность профилактики рака.
Один из типов предраковых состояний — метаплазии, при которых происходит замещение клеток одного типа клетками другого (как правило, обратимое). Метаплазии часто возникают на границах между разными типами эпителия и могут в таких случаях порождать карциномы — злокачественные опухоли эпителиальных клеток. Эпителий — это ткань, выстилающая поверхность тела (то есть, грубо говоря, кожа), внутренние полости и слизистые оболочки органов. В российской медицине различают два основных вида эпителия — многослойный плоский эпителий (кожа, слизистые оболочки, пищевод) и однослойный цилиндрический эпителий (желудок, кишечник). Особо выделяют эпителий, выстилающий органы, подвергающиеся сильному растяжению (например, в мочевыводящей системе), так называемый переходный. В западной медицине принята более детальная классификация эпителия (см. Epithelium).
Самая распространенная и активно исследуемая форма метаплазии — пищевод Барретта (синдром Барретта). Это — опасное осложнение рефлюксной болезни — заброса содержимого желудка в пищевод, при котором свойственный в норме пищеводу многослойный плоский эпителий в пограничной области соединения пищевода с желудком замещается цилиндрическим (свойственным желудку) с вкраплениями свойственных кишечнику бокаловидных клеток — «одноклеточных желез», выделяющих увлажняющую слизь (см. рис. 1). Частота встречаемости синдрома при рефлюксе составляет 10%, а в целом по популяции — 1%. За последние 40 лет частота встречаемости пищевода Барретта возросла почти в 8 раз. Он считается предраковым состоянием, так как высоколетальная аденокарцинома нижней части пищевода возникает при нем в 10 раз чаще, чем в нормальном пищеводе.
Хотя с момента описания синдрома Барретта в 1950 году он активно изучался, ключевые процессы его развития оставались неизвестными: как возникает замещение плоского эпителия на цилиндрический (метаплазия)? от каких клеток происходит вновь формирующийся цилиндрический эпителий пищевода? как идет последующая трансформация в злокачественные новообразования?
Для объяснения метаплазии было предложено пять основных теорий (они схематично показаны на рис. 2):
1) возможна прямая конверсия плоского эпителия в цилиндрический — повреждение может вызвать превращение одного типа ткани в другой (рис. 2, a);
2) предшественниками цилиндрического эпителия являются циркулирующие в кровотоке стволовые клетки, способные дифференцироваться в цилиндрический эпителий (рис. 2, b);
3) предшественниками цилиндрического эпителия являются клетки субмукозных (слизистых) желез, локализованных под плоским эпителием (рис. 2, c);
4) возможна экспансия в пограничную область клеток цилиндрического эпителия желудка (рис. 2, d);
5) предшественниками цилиндрического эпителия являются остаточные эмбриональные клетки, локализованные вблизи пограничной области (рис. 2, e).
Рис. 2. Гипотезы возникновения пищевода Барретта, предложенные ранее. a — передифференцировка плоского эпителия пищевода; b — дифференцировка циркулирующих в крови стволовых клеток костного мозга; c — экспансия клеток слизистых желез пищевода и их превращение в эпителий Барретта; d — превращение стволовых клеток слизистых желез; e — экспансия и дифференцировка спящих остаточных эмбриональных клеток пограничной области пищевода/желудка. Рисунок из обсуждаемой статьи в Nature
Но ни одна из этих теорий не получила строгого экспериментального подтверждения. И ни одна не объясняла появления вкраплений бокаловидных клеток, свойственных кишечнику (а не пищеводу или желудку).
Большой коллектив ученых из Медицинского центра Колумбийского университета и других научных учреждений США и Китая провел сравнительный анализ экспрессии генов, характерных для эпителия. Они показали, что у мышей пограничный эпителий, состоящий из базальных и люминальных (обращенных в просвет пищевода) клеток, характеризуется различной экспрессией в этих клетках трех маркеров. В базальных клетках экспрессируются два цитокератина — Krt5 и Krt7, а также фактор регуляции транскрипции р63. В клетках люминального слоя экспрессируется только Krt7. Это отличает пограничную область от выше расположенной области пищевода, в которой ни в базальных клетках, ни в плоском эпителии нет экспрессии Krt7 (рис. 1). В эпителии желудка ни один из этих маркеров не экспрессируется.
Рис. 3. Схема анастомоза между двенадцатиперстной кишкой и пищеводом мыши, в результате которого желчные кислоты (красные стрелки) поступают в пищевод. Рисунок из обсуждаемой статьи в Nature
В следующей серии экспериментов авторы провели тонкую хирургическую операцию на мышах и сделали анастомоз между пищеводом и двенадцатиперстной кишкой (рис. 3). В результате желчные кислоты поступали в пищевод, что позволило имитировать рефлюкс.
Через 18 недель после операции воздействие желчных кислот на пограничную область приводило к формированию клеток «пищевода Барретта», в которых экспрессировался характерный маркер CDX2, и в этой области появлялись бокаловидные клетки. Примечательно, что в расположенной выше части пищевода таких клеток не наблюдалось, несмотря на то что она также подвергалась воздействию желчных кислот.
Ученые решили исключить возможность замещения эпителия в пограничной области пищевода мигрирующими клетками соседних тканей. Для этого с помощью генно-инженерных методов они получили мышей, у которых экспрессия гена Krt7 в клетках эпителия пограничной области была сопряжена с экспрессией красного флюоресцирующего белка Tomato. Эксперименты показали, что в клетках цилиндрического эпителия «пищевода Барретта» экспрессируется Tomato, то есть Krt7. А как уже говорилось, ген Krt7 экспрессируется в эпителии пограничной области, но не экспрессируется в расположенной выше области пищевода и в желудке. Следовательно, клетки цилиндрического эпителия «пищевода Барретта» происходят исключительно от базальных клеток пограничной области (рис. 4).
Рис. 4. Предшественники базальных клеток (экспрессирующие гены p63 и KRT7) и люминальные клетки (KRT7 + ) эпителия пограничной области пищевод/желудок у мышей. Squamous epithelium — плоский эпителий пищевода. Transitional epithelium — эпителий пограничной области пищевода. Cardia — желудок. Рисунок из обсуждаемой статьи в Nature
В заключение авторы решили проверить, насколько похожа структура пограничной области между пищеводом желудком у человека и у мыши. Они провели анализ экспрессии эпителиальных маркеров человек и показали их сходство с мышиными. В этой области у человека были найдены базальные клетки с экспрессией генов p63, KRT5 и KRT7, а также люминальные клетки, в которых экспрессировался KRT7, но не было экспрессии гена p63. В базальных клетках, принадлежащих расположенной выше области пищевода, KRT7 не экспрессировался (рис. 5).

Рис. 5. В пограничной области пищевода и желудка человека локализован специфический переходный эпителий, который разрастается при пищеводе Барретта. a — микроскопическое изображение предшественников базальных клеток (отмечены стрелками) и люминальных клеток эпителия, окраска гематоксилином и эозином. Длина масштабного отрезка — 50 мкм. b — базальные клетки эпителия пограничной области экспрессируют гены p63, KRT5 и KRT7 (продукты экспрессии отмечены треугольниками). Базальные клетки плоского эпителия пищевода не экспрессируют KRT7 (отмечены стрелками). Иммуногистологическое окрашивание разными флюоресцирующими красителями. Длина масштабного отрезка — 50 мкм. c — схема строения эпителия пограничной области пищевод/желудок человека, обозначения как на рис. 4. Рисунок из обсуждаемой статьи в Nature
Таким образом, ученым удалось на модели лабораторных мышей охарактеризовать эпителий пограничной области между пищеводом и желудком, который дает начало предраковому состоянию — пищеводу Барретта, а также проверить, что у людей все устроено аналогично. Оказалось, что этот эпителий более чувствителен к повреждающим факторам, чем эпителий расположенных выше областей пищевода или эпителий желудка. Полученные результаты лучше всего согласуются с выдвинутой ранее гипотезой происхождения пищевода Барретта о прямом превращении тканей эпителия пограничной области: показано, что базальные клетки пограничного эпителия могут быть предшественниками эпителия, подобного кишечному, который включает и бокаловидные клетки.
В то же время выявленные в ходе исследования генетические маркеры клеток эпителия пограничной зоны как таковые вряд ли могут быть причиной формирования пищевода Барретта и дальнейшего развития рака. В этом, скорее всего, задействованы какие-то иные факторы — кислотный рефлюкс, другие химические раздражители, гормональные нарушения или вирусные инфекции.
Несмотря на оставшиеся вопросы, обсуждаемая работа дает детальную картину формирования пищевода Барретта. Поскольку предраковые состояния и злокачественные опухоли особенно часто возникают именно в пограничных областях эпителия разных органов (матка, пищевод, прямая кишка), то можно надеяться, что там работают аналогичные механизмы. Впрочем, дальнейшие исследования должны будут прояснить этот вопрос, равно как и то, является ли пограничный эпителий единственным местом возникновения этой метаплазии и дальнейшей трансформации ее в рак. Ведь уже давно было показано, что структура, подобная пищеводу Барретта, может возникнуть и у больных, у которых пограничная область пищевода была удалена (S. R. Hamilton, J. H. Yardley, 1977. Regnerative of cardiac type mucosa and acquisition of Barrett mucosa after esophagogastrostomy). Так что полученные результаты могут способствовать разработке методов диагностики, профилактики и лечения этих состояний не только применительно к пищеводу, но и к другим органам.
Источники:
1) Ming Jiang, Haiyan Li, Yongchun Zhang, Ying Yang, Rong Lu, Kuancan Liu, Sijie Lin, Xiaopeng Lan, Haikun Wang, Han Wu, Jian Zhu, Zhongren Zhou, Jianming Xu, Dong-Kee Lee, Lanjing Zhang, Yuan-Cho Lee, Jingsong Yuan, Julian A. Abrams, Timothy C. Wang, Antonia R. Sepulveda, Qi Wu, Huaiyong Chen, Xin Sun, Junjun She, Xiaoxin Chen & Jianwen Que. Transitional basal cells at the squamous-columnar junction generate Barrett’s oesophagus // Nature. 2017. V. 550. P. 529–533.
2) Lizhe Zhuang & Rebecca C. Fitzgerald. Cancer development: Origins in the oesophagus // Nature. 2017. V. 550. P. 463–464. Синопсис к обсуждаемой статье.