Что такое блрс в микробиологии
Бактериемия, вызванная кишечной палочкой, продуцирующей бета-лактамазы расширенного спектра
В настоящее время отмечается распространение штаммов Escherichia coli, продуцирующих бета-лактамазы расширенного спектра (БЛРС), в частности, БЛРС типа CTX-M. Данный полирезистентный микроорганизм все чаще становится причиной тяжёлых внебольничных инфекций. Бактериемия, вызванная БЛРС-продуцирующей E.coli, представляет терапевтическую проблему, поскольку возбудитель часто оказывается резистентным к антимикробным препаратам, используемым для лечения пациентов с предполагаемым сепсисом, вызванным E.coli.
В клинической больнице на 900 коек, обслуживающей население в 550 тыс. человек, проведен анализ предрасполагающих факторов, клинических особенностей и исходов инфекций кровотока, вызванных БЛРС-продуцирующими штаммами E.coli. БЛРС изучались с помощью изоэлектрофокусировки, полимеразной цепной реакции и секвенирования.
Зарегистрировано 43 случая инфекций кровотока, вызванных БЛРС-продуцирующей E.coli, что составляет 8,8% от всех случаев бактериемии, вызванной E.coli; 70% штаммов продуцировали БЛРС типа CTX-M. Количество случаев возросло с 6 в 2001 г. до 16 в 2004 г. Очаг инфекции в большинстве случаев локализовался в мочевых (46%) или желчевыводящих путях (21%). Двадцать один случай инфекции (49%) имел нозокомиальное происхождение, 14 (32%) были связаны с оказанием медицинской помощи и 8 (19%) были внебольничными. Обструкция мочевыводящих или желчевыводящих путей отмечалась у 38% и 25% пациентов, соответственно. Анамнез недавней предшествующей антимикробной терапии имелся у 38% пациентов. Летальность составила 21%. Летальные исходы были отмечены только среди пациентов с нозокомиальными и связанными с оказанием медицинской помощи случаями инфекций.
Эмпирическая антимикробная терапия была соответствующей только у 51% пациентов. Эмпирическая терапия цефалоспоринами или фторхинолонами по сравнению с терапией комбинацией бета-лактамный антибиотик/ингибитор бета-лактамаз или карбапенемом сопровождалась более высокой летальностью (35% vs 9%; р=0,05) и чаще требовала модификации (78% vs 24%; р=0,001).
Таким образом, кишечная палочка, продуцирующая бета-лактамазы расширенного спектра, является частой причиной инфекций кровотока среди стационарных и амбулаторных пациентов в условиях распространения бета-лактамаз CTX-M. В регионах, где распространены штаммы, продуцирующие бета-лактамазы расширенного спектра, требуется пересмотреть эмпирическую терапию сепсиса, предположительно вызванного E.coli.
Rodriguez-Bano J, Navarro MD, Romero L, Muniain MA, de Cueto M, Rios MJ, Hernandez JR, Pascual A.
Bacteremia due to extended-spectrum beta-lactamase-producing Escherichia coli in the CTX-M era: a new clinical challenge.
Clin Infect Dis 2006; 43(11):1407-14.
Бактерии, вырабатывающие бета-лактамазу расширенного спектра (ESBL)
Эта информация рассказывает о бактериях, вырабатывающих бета-лактамазу расширенного спектра (ESBL), в том числе о путях их распространения и способах лечения вызываемых ими инфекций.
Что представляет собой бета-лактамаза расширенного спектра?
Некоторые микроорганизмы, к примеру, кишечная палочка (E. coli) и клебсиелла, вырабатывают фермент, называемый бета-лактамазой расширенного спектра (ESBL). Этот фермент делает микроорганизмы более стойкими к антибиотикам.
Микроорганизмы, вырабатывающие ESBL, могут вызывать различные заболевания, например:
В чем состоит разница между колонизацией и инфицированием микроорганизмами, вырабатывающими ESBL?
Человек может быть либо колонизирован, либо инфицирован микроорганизмами, вырабатывающими ESBL. Колонизация означает наличие микроорганизмов на коже или в организме человека при отсутствии каких-либо симптомов заболевания. Инфицирование означает наличие микроорганизмов на коже или в организме, и при этом они вызывают заболевание.
Как распространяются микроорганизмы, вырабатывающие ESBL?
Большинство инфекций, вызываемых вырабатывающими ESBL микроорганизмами, распространяется через прямой контакт с физиологическими жидкостями инфицированного человека (кровь, выделения из раны, моча, стул или флегма). Также они могут распространяться через контакт с оборудованием или поверхностями, которые могут быть заражены бактериями. Они не распространяются при простом контакте, например через прикосновение или объятие.
Кто подвержен риску инфицирования микроорганизмами, вырабатывающими ESBL?
Инфекции, вызываемые вырабатывающими ESBL бактериями, чаще возникают у людей:
Каковы симптомы инфекции, вызываемой вырабатывающими ESBL микроорганизмами?
Симптомы будут зависеть от места возникновения и типа инфекции.
Каковы методы лечения инфекции, вызываемой вырабатывающими ESBL микроорганизмами?
Инфекции, вызываемые вырабатывающими ESBL микроорганизмами, лечатся антибиотиками, к которым у них нет устойчивости. Ваш врач выберет для вас лекарство(-а) в зависимости от того, где возникла инфекция, и какой микроорганизм ее вызвал.
Какие меры по изоляции принимаются в больнице, если у меня обнаруживается инфекция, вызываемая вырабатывающими ESBL микроорганизмами?
Соблюдение таких мер может быть прекращено после того, как вы пройдете курс лечения и больше не будете являться источником инфекции для других. Ваш врач или медсестра/медбрат скажут вам, когда можно будет прекратить соблюдать эти меры.
Какие меры по изоляции мне следует принять дома, если у меня обнаружится инфекция, вызываемая вырабатывающими ESBL микроорганизмами?
Если у вас диагностировали инфекцию, вызываемую вырабатывающими ESBL микроорганизмами, соблюдайте следующие предписания:
Где я могу получить дополнительную информацию об инфекциях, вызываемых вырабатывающими ESBL микроорганизмами?
Если у вас есть вопросы, обратитесь к своему врачу или медсестре/медбрату. Кроме того, для получения дополнительной информации вы можете посетить веб-сайт:
Что такое блрс в микробиологии
СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА ЧАСТОТЫ ВСТРЕЧАЕМОСТИ И АНТИБИОТИКОРЕЗИСТЕНТНОСТИ ШТАММОВ KLEBSIELLA PNEUMONIAE И ESCHERICHIA COLI, ПРОДУЦИРУЮЩИХ БЕТА-ЛАКТАМАЗЫ РАСШИРЕННОГО СПЕКТРА В ДЕТСКОМ СТАЦИОНАРЕ
Продукция БЛРС (бета-лактамаз расширенного спектра) у нозокомиальных штаммов семейства Enterobacteriaceae, особенно у Klebsiella pneumoniae и E. coli является одним из наиболее частых и значимых механизмов резистентности к антибактериальным препаратам в стационарах России. В настоящее время описано более 350 бета-лактамаз, из них более 100 обуславливает резистентность к цефалоспоринам I–IV поколения и азтреонаму. Штаммы, вырабатывающие БЛРС, также часто имеют гены резистентности к аминогликозидам, фторхинолонам, ко-тримоксазолу [1].
При изучении распространенности бета-лактамаз расширенного спектра у нозокомиальных штаммов в различных стационарах России в 1997–1998 гг. и в 2003 г. было установлено, что частота встречаемости БЛРС существенно отличается по регионам РФ, между стационарами одного города, даже между отделениями одного стационара. Так в восьми стационарах г. Москвы были обнаружены БЛРС у 10,0; 16,7; 17,0; 23,7; 26,5; 58,3; 87,1 и 90,0 % штаммов соответственно [2].
Частота распространенности БЛРС-продуцирующих энтеробактерий в стационарах некоторых городов России [3] за 2003 г. представлена в табл. 1.
Частота распространенности штаммов энтеробактерий, продуцирующих БЛРС, в стационарах некоторых городов России
Из таблицы видно, что частота выделения штаммов, продуцирующих БЛРС, в стационарах некоторых городов России очень высокая. Распространенность в среднем по России Klebsiella pneumoniae составляет от 60,2 % до 84,3 %, E. coli – от 15,8 % до 54,7 % [3].
Бета-лактамазы расширенного спектра в настоящее время широко распространены в большинстве стран мира. Частота обнаружения БЛРС у штаммов Klebsiella pneumoniae и E. coli в некоторых странах [4–6] представлена в табл. 2.
Частота обнаружения БЛРС в некоторых странах мира
Из таблицы видно, что самая низкая частота встречаемости БЛРС продуцирующих штаммов в Канаде, США и Европе, а самая высокая – в странах Азии, Латинской Америке, Саудовской Аравии.
Резистентность энтеробактерий приобретает все большее распространение и является серьезной проблемой в здравоохра- нении.
Цель работы: изучить распространенность нозокомиальных штаммов Klebsiella pneumoniae и E. coli, продуцирующих БЛРС и их антибиотикорезистентность в детском стационаре Тульской области для проведения более рациональной и эффективной антибактериальной терапии.
Материалы и методы исследования
Материалом для исследования служил биологический материал (моча, кал, мазки из зева и носа, кровь на стерильность и прочее), полученный от детей, находящихся на лечении в детском стационаре ГУЗ «Тульская детская областная клиническая больница» в 2017–2019 гг.
Выделение чистых культур Klebsiella pneumoniae и E. coli проводили классическим бактериологическим методом, а видовую идентификацию, определение БЛРС и чувствительность к антибиотикам – с помощью автоматизированной микробиологической системы Phoenix-100, производителем которой является компания Becton Dickinson (США).
Результаты исследования и их обсуждение
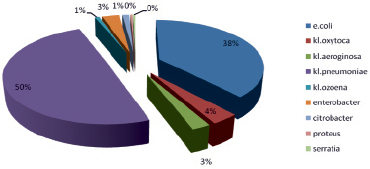
Всего за 2017–2019 гг. было выделено от детей 1017 штаммов (460 – Klebsiella pneumonia, 557 – E. coli) из различного биологического материала (кал, моча, мазки из зева и др.). При изучении пейзажа выделенных культур, продуцирующих БЛРС, установлено, что наибольший удельный вес приходится на Klebsiella pneumonia (50 %) и E. coli (38 %), на другие энтеробактерии – 12 % (рис. 1).
Рис. 1. Пейзаж выделенных культур-продуцентов БЛРС за 2017–2019 гг.
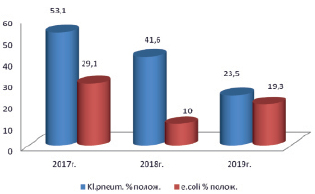
Рис. 2. Частота встречаемости БЛРС продуцирующих Klebsiella pneumonia и E. coli за 2017–2019 гг.
Частота БЛРС-позитивных штаммов у Klebsiella pneumoniae составила от 23,5 % до 53,1 %; у E. coli – от 10 % до 29,1 %.
Количество штаммов Klebsiella pneumoniae, продуцирующих бета-лактамазы расширенного спектра, в 2 раза больше, чем штаммов E. coli. Частота встречаемости штаммов, продуцирующих БЛРС, за 2017–2019 гг. представлена на рис. 2.
Мы видим, что в 2019 г. наметилась тенденция к снижению БЛРС продуцирующих штаммов Klebsiella pneumoniae и E. coli.
Частота встречаемости штаммов, продуцирующих бета-лактамазы расширенного спектра, отличается не только по годам, но и по отделениям детского стационара. Наибольшая частота встречаемости – в отделении анестезиологии и реанимации (около 90 %), педиатрическом – до 48 %, отделении патологии новорожденных (ОПН) – 37 %, нефрологическом – 5,8 %. Самая низкая встречаемость нозокомиальных штаммов-продуцентов БЛРС – в нефрологическом отделении.
Антибиотикорезистентность к бета-лактамным и небета-лактамным препаратам представлена в табл. 3.
Антибиотикорезистентность штаммов, продуцирующих БЛРС в 2019 г.
Из таблицы видно, что наиболее распространенной была резистентность к цефалоспоринам III–IV поколения (цефотаксиму, цефтазидиму, цефтриаксону, цефиксиму, цефепиму), ингибиторозащищенным пенициллинам (амоксициллин/клавуланат, ампициллин/сульбактам) и триметоприму.
Наиболее активными препаратами в отношении E. coli среди бета-лактамных препаратов были пиперациллин/тазобактам (93 %) и карбопенемы: имипенем (97 %), меропенем (91,7 %) и небета-лактамный препарат – фосфомицин (93 %).
Klebsiella pneumoniae была более чувствительна к имипенему (95 %) и из класса аминогликозидов – амикацину (93,8 %).
Отмечается высокая чувствительность Klebsiella pneumoniae и E. coli к цефоперазону/сульбактаму (100 % и 94 %) соответственно.
Выводы
Выявлена распространенность нозокомиальных штаммов Klebsiella pneumoniae и E. coli, продуцирующих БЛРС в детском стационаре, которая составляет от 23,5 % до 53,1 % и от 10 % до 29,1 % в разные годы соответственно. Частота встречаемости Klebsiella pneumoniae в детском стационаре в 2 раза больше, чем у штаммов E. coli. Наметилась положительная тенденция в 2019 г. к снижению БЛРС продуцирующих нозокомиальных штаммов Klebsiella pneumoniae и E. coli.
Наибольшая частота встречаемости Klebsiella pneumoniae и E. coli в отделении анестезиологии и реанимации, отделении патологии новорожденных, педиатрическом отделении. Наименьшая частота встречаемости нозокомиальных штаммов, продуцирующих БЛРС – в нефрологическом отделении.
Отмечается высокая антибиотикорезистентность у штаммов-продуцентов БЛРС к ингибиторозащищенным пенициллинам, цефалоспоринам III–IV поколения и триметоприму.
Также отмечается высокая чувствительность Klebsiella pneumonia к имипенему (95 %), амикацину (93, 8 %) и цефоперазону/сульбактаму (100 %).
Наиболее активными препаратами в отношении E. coli являются пиперациллин/тазобактам (93 %), цефоперазон/сульбактам (94 %), имипенем (97 %), меропенем (91,7 %), фосфомицин (93 %).
Таким образом, необходимо проводить своевременную и регулярную диагностику бета-лактамаз расширенного спектра среди энтеробактерий, которая способствует проведению рациональной и эффективной антибактериальной терапии.
Что такое блрс в микробиологии
В настоящее время четко определены основные серьезные проблемы, связанные с антибиотикорезистентностью бактерий, ответственных за развитие НКИ: MRS A, MRS-КНС, VRE, штаммы грамотрицатсльных палочек, продуцирующих БЛРС (Klebsiella pneumoniae и Е. Coli), мультирезистентные и папрезистентные штаммы энтеробактерий, неферментирующих грамотрицательных палочек А. baumannii и P. aeruginosa, появление штаммов стафилококков и энтерококков, резистентных к ванкомицину и линезолиду (Guideline for Isolation Precautions: Preventing Transmission of Infectious Agents in Healthcare Settings Recommendations of the Healthcare Infection Control Practices).
Термины «мультрезистентность» (МDR, резистентность бактерии к трем классам антибиотиков и более), «экстенсивная или чрезвычайно высокая резистентность» (XDR, резистентность бактерии ко всем классам антибиотиков кроме одного или двух классов) и «панрезистентность» (PDR, резистентность бактерии ко всем классам антибиотиков) все чаще используются в литературе для описания различного уровня антим и кробной резистентности бактерий.
Ключевая роль лаборатории клинической микробиологии состоит в своевременном и точном выявлении MDR у микроорганизмов, представляющих возбудителей НКИ. Существуют различные доступные в настоящее время методы диагностики резистентности (стенотипический, молекулярный, микробиологические анализаторы MDR, составляет 19 и 33% соответственно. Назначение хиполонов и антипсевдомонадных пенициллинов служит независимым фактором риска резистентности к карбапенемам у зитеробактерий.
Инфекции, вызванные штаммами PDR-Enterobacteriaceае, связаны с высокой летальностью. Общая летальность при PDR-К. pneumoniae составляет 100% с атрибутивной летальностью 25 %. К. pneumoniae в последние годы считают наиболее «проблемным» микроорганизмом из семейства Enterobacteriaceae, у которого часто выявляется XDR или даже PDR.
По нашим данным, Е. coli, К. pneumoniae и Е. cloacae — это основные виды грамотрицательных палочек из семейства зитеробактерий, которые вызывают послеоперационные РИ у онкологических больных. Все три вида имеют свои особенности, которые необходимо учитывать при назначении антибактериальных препаратов.
При определении чувствительности грамотрицательных палочек семейства Enterobacteriaceae весьма важен поиск штаммов, способных вырабатывать ферменты, объединенные в группу бета-лактамаз расширенного действия (БЛРС). Инфекции, обусловленные микроорганизмами, продуцирующими такие ферменты, поддаются терапии ограниченным количеством антимикробных препаратов. Обоснованные рекомендации по выявлению БЛРС фенотипическими методами распространяются только на штаммы Klebsiella spp. и Е. coli. Выработка БЛРС может быть выявлена практически у всех видов этого семейства и даже у целого ряда других грамотрицательных палочек.
Продуценты бета-лактамаз расширенного действия (БЛРС) устойчивы ко всем пенициллинам, цефалоспоринам и монобактамам, даже когда in vitro эти препараты эффективны, Существуют различные методы выявления микроорганизмов, вырабатывающих бета-лактамаз расширенного действия (БЛРС), доступные практическим лабораториям. Ориентировочно можно предположить способность грамотрицательных палочек к продукции бета-лактамаз расширенного действия (БЛРС), если in vitro отмечается снижение чувствительности к таким препаратам, как цефподоксим, цефтазидим, цефтриаксон, цефотаксим или азтреонам.
Далее, при выявлении подавления действия b-лактамаз ингибиторами (например, сульбактамом, клавулановой кислотой, тазобактамом) можно утверждать, что данный штамм вырабатывает БЛРС (CLSI, M100-S18, 2003).
Следует отметить высокую чувствительность всех штаммов энтеробактерий отечественных клиниках к карбаненемам. При этом к имипенему отмечается более низкая по сравнению с меропенемом чувствительность, особенно в группе Proteus spp., где чувствительность к меропенему достоверно выше по сравнению с имипенемом (97,7% против 54,2% соответственно).
In vitro чувствительность энтеробактерий к препаратам группы аминогликозидов от 30 до 100% и весьма зависит не только от рода, по и от вида энтеробактерий, что подтверждает необходимость организации микробиологических исследований на высоком уровне, который может быть обеспечен в современных условиях.
Такие же выводы можно сделать и в отношении фторх и полонов (ципрофлоксацин, левофлоксацин). В крупных международных исследованиях отмечается высокий процент устойчивых к ципрофлоксацину штаммов E. coli, что наблюдается и в отечественных клиниках: около половины штаммов кишечной палочки устойчивы к ципрофлоксаципу. Многофакторный анализ показал, что профилактика фторхиполопами достоверно связана с увеличением устойчивости микроорганизмов к фторхинолонам и с продукцией БЛРС Е. coli.
Кроме того, монотерапия фторхинолонами в сравнении со всеми другими антимикробными препаратами статистически значимо чаще связана с развитием бактериемии на фоне антибиотикотерапии (так называемая «бактериемия прорыва» — breakthrough bacteriemia), обусловленной P. aeruginosa, Е. coli, а также MRSA.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Что такое блрс в микробиологии

Поиск
ДЕТЕКЦИЯ БЕТА-ЛАКТАМАЗ AmpCУКЛИНИЧЕСКИХ ИЗОЛЯТОВ ЭНТЕРОБАКТЕРИЙ
УДК 616.98
1 Казанская государственная медицинская академия — филиал ФГБОУ ДПО РМАНПО Минздрава России, 420012, Казань, ул. Бутлерова, д. 36
2 Республиканская клиническая инфекционная больница имени профессора А.Ф. Агафонова, лабораторный диагностический центр, 420061, Казань, ул. Ершова, д. 54
Контактная информация:
Поздеев Оскар Кимович — профессор, доктор медицинских наук, заведующий кафедрой микробиологии, тел. (843)233-34-78, e-mail: [email protected]
Куряева Назия Юнусовна — заместитель главного врача по лабораторной диагностике, тел. +7-917-257-18-10.
Валиуллина Альфия Зямилевна — врач-бактериолог, тел. +7-917-935-19-03, e-mail: [email protected]
Караганов Владимир Александрович — врач-бактериолог, тел. +7-904-679-80-45, e-mail: [email protected]
Шулаева Марина Петровна — кандидат биологических наук, доцент кафедры микробиологии, тел. (843)233-34-78, e-mail: [email protected]
Статья поступила: 7.02.2018, принята к печати: 28.03.2018.
В данной статье рассмотрены аспекты продукции β-лактамаз класса AmpC некоторыми представителями семейства Enterobacteriaceae. Предлагается простая и эффективная методика определения β-лактамаз класса AmpC, применимая в рутинной практике бактериологических лабораторий, что имеет большое значение для адекватного выбора антимикробных препаратов при назначении терапии лечащим врачом.
Ключевые слова: нозокомиальные инфекции, β–лактамазы, энтеробактерии, антимикробные препараты.
(Для цитирования: Поздеев О.К., Куряева Н.Ю., Валиуллина А.З., Караганов В.А., Шулаева М.П. Детекция бета-лактамазampc у клинических изолятов энтеробактерий. Практическая медицина. 2018)
O.K. POZDEEV 1 , N.Yu. KURYAEVA 2 , A.Z. VALIULLINA 2 , V.A. KARAGANOV 2 , M.P. SHULAEVA 1
1 Kazan State Medical Academy — Branch Campus of the RMACPE MOH Russia, 36 Butlerov Str., Kazan, Russian Federation, 420012
2 Republic Clinical Infectious Hospital named after Prof. A.F. Agafonov, 54 Ershov Str., Kazan, Russian Federation, 420061
Detection of ampC b-lactamases in clinical isolates of enterobacteria
Pozdeev O.K. — D. Med. Sc., Professor of the Department of Microbiology, tel. (843)233-34-78, e-mail: [email protected]
Kuryaeva N.Yu. — Deputy Chief Doctor for Laboratory Diagnostics, tel. +7-917-257-18-10
Valiullina A.Z. — bacteriologist, tel. +7-917-935-19-03, e-mail: [email protected]
Karaganov V.A. — bacteriologist, tel. +7-904-679-80-45, e-mail: [email protected]
Shulaeva M.P. — Cand. Med. Sc., Associate Professor of the Department of Microbiology, tel. (843) 233-34-78, e-mail: [email protected]
The article views certain aspects of AmpC class β-lactamases synthesis by some species of Enterobacteriaceae family. The authors propose a simple and efficient method of AmpC β-lactamases detection, applicable in the routine practice of bacteriological laboratories. The means of detecting the ability to produce such enzymes are important for the adequate choice of antibacterial medications by an attending physician.
Key words: nosocomial infections, b-lactamases, enterobacteria, antimicrobic medications.
На протяжении последних пятидесяти лет в клинической практике отмечают неуклонный рост числа нозокомиальных инфекций, вызванных представителями семейства Enterobacteriaceae и одновременно перманентно возрастающую устойчивость этих бактерий к антимикробным препаратам (АМП) различных классов. Сложившаяся ситуация во многом обусловлена неадекватностью, проводимой эмпирической антибактериальной терапии и ограниченным арсеналом АМП с подтвержденной эффективностью. И на сегодняшний день одной из самых серьезных проблем для современной практической медицины представляют энтеробактерии, проявляющие множественную устойчивость к различным АМП. Распространение подобных штаммов приводит к увеличению сроков госпитализации, росту летальности, а также существенно увеличивает экономические затраты. Особую тревогу вызывает распространение полирезистентности бактерий к β-лактамным антибиотикам (включая карбапенемы), так как набор антибактериальных препаратов, эффективно подавляющих их рост, сегодня ограничен [1, 2].
В значительной степени устойчивость представителей семейства Enterobacteriaceae обусловлена способностью к образованию бета-лактамаз расширенного спектра (БЛРС), являющихся своеобразным маркером полирезистентности. При этом изоляты, способные к их продукции, также нередко имеют генетически детерминированную резистентность к АМП других классов (аминогликозидам, фторхинолонам, ко-тримоксазолу). Кроме того, в последние годы установлено носительство (до 40 %)штаммов-продуцентов БЛРС у лиц, не имевших в анамнезе контакта со стационарами, что указывает на их циркуляцию во внебольничных условиях [3–5].
В этом плане особый интерес представляют бета-лактамазы АmpС (цефалоспориназы) грамотрицательных бактерий, не ингибирующиеся клавулановой кислотой. К настоящему времени уже описано более 20 подобных ферментов. У некоторых энтеробактерий цефалоспориназы, кодируемые хромосомными генами, могут экспрессироваться, хотя и на низком уровне, постоянно (например, у E.coli). У других микроорганизмов группы (например, у представителей Enterobacter, Serratia, Morganella и др.) их синтез носит индуцибельный характер, но при нарушении регуляторных механизмов образование АmpС приобретает характер постоянной гиперпродукции. Установлено, что, после появления цефалоспоринов III поколения частота обнаружения подобных штаммов-гиперпродуцентов AmpC в некоторых странах Европы достигает 70 %, а позднее феномен гиперсинтеза АmpС был выявлен у изолятов кишечной палочки и клебсиелл. Следует отметить, что особую угрозу представляет широкое распространение бета-лактамаз АmpС, кодируемых плазмидными генами, как фактора приобретенной резистентности, в том числе у изначально чувствительных энтеробактерий. При этом плазмидные цефалоспориназы AmpC энтеробактерий обусловливают широкий спектр резистентности, включая цефалоспорины III поколения и комбинации бета-лактамных антибиотиков с ингибиторами, являющихся до сих пор самыми «популярными» антибиотиками [6, 7].
В настоящей работе проведено исследование способности представителей семейства Enterobacteriaceae, выделенных из различного клинического материала, к гиперпродукции бета-лактамазAmpC.
Цель исследования: провести изучение эффективности метода выявления гиперпродукции бета-лактамаз AmpC энтеробактериями по величине зон подавления роста бактерий с помощью дисков с цефокситином и цефепимом.
Материалы и методы.
Исследования проведены в бактериологической лаборатории ГАУЗ ГДЦ по ЛДИЗ г. Казани и на базе кафедры микробиологии КГМА в период с 01.07.2014 по15.12.2014 и с 16.12.2014 по 15.12. 2015.
Культуры энтеробактерий были выделены при проведении рутинных бактериологических исследований клинического материала, которым служило: раневое отделяемое, мазки из ушей и глаз, отделяемое половых органов, мокрота, моча, желчь, ликвор, кровь, грудное молоко, секционный материал, а также отпечатки плаценты, отобранные у новорожденных, входящих в группу риска по внутриутробным инфекциям (ВУИ), с клиническими проявлениями гнойно-воспалительных заболеваний. Материал для исследований был получен из стационаров и поликлиник г. Казани.
Принадлежность выделенных микроорганизмов к семейству Enterobacteriaceae определяли общепринятыми методами в соответствии с положениями:
Идентификацию культур проводили на тест-системах MIKROLATEST и ENTEROtest 16 (ErbaLachemas, Чехия). Также применяли дополнительные биохимические тесты: посевы на жидкую среду с глюкозой (на кислото- и газообразование), на полужидкий агар (для определения подвижности), на среду Кларка (для реакции с метиловым красным и реакции Фогеса-Проскауэра), на среду с аргинином (для определения способности к синтезу аргининдегидролазы), на жидкую среду с арабинозой.
Автоматическое считывание идентификационных тест-систем проводили планшетным фотометром «Multiscan — Ascent»96/384 (MTXLABSystemsInc, США), результаты дополнительных тестов в базу данных компьютера вводили вручную.
Контроль качества ENTEROtest 16 проводили согласно прилагаемой инструкции с помощью контрольных,референтных бактериальных культур SerratiamarcescensCCM 303, Proteusvulgaris ССМ 1799 и Edvardsiellatarda ССМ 2238.
Изучение чувствительности к антибиотикам проводили диско-диффузионным методом на агаре Мюллер-Хинтона в соответствии с рекомендациями МУК 4.2.1890-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам». Способность к гиперпродукции бета — лактамаз AmpC определяли с помощью дисков сцефокситином (30мкг) и цефепимом (30мкг) производства Bio-RadLaboratories, Inc (США).
Для этого к препаратам первого ряда: ампициллин (10мкг), амоксициллин-клавуланат (20/10 мкг), гентамицин (10 мкг)ципрофлоксацин (5 мкг)цефотаксим (30мкг) цефтазидим (30мкг) добавляли диски с цефокситином (30мкг) и цефепимом (30 мкг). Если изолят оказывался чувствительным к цефокситинуи резистентным к цефепиму при устойчивости к цефтазидиму и цефотаксиму, то его расценивали как возможный продуцент БЛРС. Если он проявлял устойчивость к цефокситину, но был чувствительным к цефепиму, а также был устойчив к цефотаксиму и цефтазидиму, то его определяли, как штамм — гиперпродуцентплазмидной AmpC. EUCAST рекомендует снизить дозу цефтазидима до 10 мкг, цефотаксима до 5 мкг, для более высокой чувствительности при детекции БЛРС.
Исследования в соответствии с рекомендациями EUCAST 2015 (Европейского Комитета по определению чувствительности микроорганизмов к антибиотикам) не проводили, так как в период проведения исследований они еще не были внедрены в практику лаборатории.
Внутрилабораторный контроль дисков с антибактериальными препаратамицефепимом и цефокситином проводили с использованием контрольного штамма E. coli АТСС 25922.
Результаты и обсуждение
Основным клиническим материалом, поступившим на исследование из поликлиник г. Казани, являлась моча. Из всего объема образцов, поступивших с июня 2014 г. по декабрь 2015 г., было выделено 162 изолята кишечной палочки. Среди них было протестировано 11 штаммов. Исследовали изоляты, которые были устойчивыми к цефотаксиму, цефтазидиму (вероятные продуценты БЛРС) и только те из них, которые проявили чувствительность к цефепиму и устойчивость к цефокситину, всего 3 культуры (27,3 %) оказались способны к гиперпродукции AmpC.
Значительно большее количество бактерий-продуцентов АmрС (17 изолятов) было выделено из различных образцов клинического материала, полученных из стационаров г. Казани (табл. 1).
Несмотря на то, что количество образцов, полученных из стационаров, было больше таковых, доставленных из поликлиник, можно заключить, что в целом штаммы — гиперпродуценты AmpC в клинических образцах из стационаров встречались чаще. Ввиду малого количества протестированных культур Morganellamorganii (2) обнаруженные культуры — продуценты AmpC были оформлены в виде списков для предоставления заинтересованных ЛПУ и не подлежат статистическому анализу.
Таблица 1.
Результаты изучения способности представителей семейства Enterobacteriaceae, выделенных из всего клинического материала (в том числе из мочи, мокроты, раневого отделяемого) к гиперпродукцииAmpC
изолятов
n (%)
freundii
morganii
Полученные результаты подтверждают результаты многочисленных исследований о преобладании изолятов энтеробактерий, способных к гиперпродукции плазмидных AmpC, среди культур, выделенных от больных, получающих длительную или интенсивную антибиотикотерапию. Зависимость частоты выделения культур- продуцентов АmрС от диагноза и вида биоматериала представлена в табл. 2.
Таблица 2.
Частота выделения бактерий-продуцентов АmрСиз различных биоматериалов, отобранных у пациентов, находящихся на стационарном лечении
| Вид клинического материала | Диагноз | Количество штаммов-продуцентов АmрС | Вид микроорганизма |
| Моча | Хронический пиелонефрит | 2 | Е. coli |
| Мокрота | Внебольничная пневмония | 2 | Enterobacteraerogenes Enterobactercloaceae |
| Мазок из зева новорожденного | Пневмония | 2 | Enterobactercloaceae |
| Мазок из носа новорожденного | Пневмония | 1 | Enterobactercloaceae |
| Эндотрахеальная трубка новорожденного | Пневмония | 1 | Enterobacteraerogenes |
| Пупочная рана | ВУИ | 1 | Enterobactercloaceae |
| Раневое отделяемое | обследование | 1 | Enterobacteraerogenes |
| инфицированная рана | 1 | Enterobactercowanii | |
| диабетическая гангрена | 1 | E. coli | |
| парапроктит | 1 | E. coli | |
| трофическая язва | 1 | Citrobacterfreundii | |
| атеросклероз | 1 | Citrobacterfreundii | |
| флегмона | 1 | Citrobacterfreundii | |
| гангрена | 1 | Morganellamorganii |
Интерес представляет и тот факт, что среди 284 протестированных изолятов кишечной палочки лишь 4 были способны к гиперпродукции AmpC, кодируемых плазмидными генами. Этот факт можно объяснить тем, что у этих бактерий достаточно распространены хромосомные гены, кодирующие синтез подобных БЛРС и их наличие, препятствует горизонтальному переносу плазмидных генов [8].
В ходе проведенного исследования установлено, что наибольшее количество штаммов-продуцентов АmpС было обнаружено в образцах клинического материала, полученного от новорожденных, находящихся на лечении в отделениях интенсивной терапии и реанимации детских стационаров, что указывает на внутрибольничную циркуляцию подобных бактерий (табл. 3).
Таблица 3.
Частота обнаружения штаммов — гиперпродуцентов плазмидных β-лактамаз AmpC среди представителей семейства Enterobacteriaceae в различных образцах клинического материала, полученного из стационаров.
| Клинический материал | Enterobactercloaceae | Enterobacter aerogenes | Enterobactercowanii | E. coli | Citrobacterfreundii | Morganellamorganii | Итого | количествопротестиров. штаммов | N (%) частота выделения изолятовАмрС |
| Раневое отделяемое | — | 1 | 1 | 2 | 3 | 1 | 8 | 478 | 1,67% |
| Моча | — | — | — | 2 | — | — | 2 | 122 | 1,63% |
| Мокрота | 1 | 1 | — | — | — | — | 2 | 39 | 5,12% |
| Мазок из зева новорожденного | 2 | — | — | — | — | — | 2 | 20 | 10% |
| Мазок из носа новорожденного | 1 | — | — | — | — | — | 1 | 12 | 8,33% |
| Эндотрахеальная трубка новорожденного | — | 1 | — | — | — | — | 1 | 20 | 5% |
| Пупочная рана | 1 | — | — | — | — | — | 1 | 6 | 16,6% |
На основании полученных результатов можно сделать следующие выводы:
КОНФЛИКТ ИНТЕРЕСОВ
Авторы статьи подтвердили отсутствие конфликта интересов, финансовой поддержки, о которых необходимо сообщить.