Что такое блокатор гистаминовых н1 рецепторов
Антигистаминные препараты при аллергии: как сделать выбор?
Антигистаминные препараты – лекарственные средства, направленные на блокировку рецепторов гистамина – химического вещества в организме, которое регулирует сон и пробуждение.
А также способно вызвать аллергические реакции: отек дыхательных путей, нарушение работы желудочно-кишечного тракта и сердечно-сосудистой системы.
Существует несколько поколений антигистаминных препаратов. В чем их отличие и для чего их применяют?
Антигистаминные препараты 1-го поколения
Медикаменты этой разновидности с легкостью преодолевают преграду между кровью и головным мозгом, за счет чего вызывают сонливость и рассеянность внимания. Эта группа лекарств имеет кратковременное действие, поэтому их нужно принимать несколько раз в течение дня.
Антигистаминные препараты 1-го поколения снижают напряжение в мышечных тканях человека, борются с симптомами аллергии и могут использовать в качестве анестетика. К этой группе относятся:
Антигистаминные препараты 2-го поколения
Отличие препаратов второго поколения от первой группы заключается в том, что у этих медикаментов нет седативного эффекта. Кроме того, человек может принимать всего одну таблетку в день. Эти препараты более активные, их работа в основном направлена на устранение аллергических реакций. Именно эти препараты врачи могут назначить на продолжительный срок лечения аллергических реакций.
К антигистаминным 2-го поколения относятся:
Антигистаминные препараты 3-го поколения
Исследование и разработка антигистаминных препаратов не стоит на месте. В чём же преимущество препаратов третьего поколения?
Лекарства этой группы быстро всасываются из желудочно-кишечного тракта, поэтому действие препарата наступает быстрее. Не вызывают привыкания и не обладают седативным эффектов, т.е. не вызывают сонливости. Часто используются при лечении кожных аллергических реакций, зуда и покраснений.
К препаратам 3-го поколения относятся:
Антигистаминные препараты всех трех поколений можно приобрести в Аптеках «Столички».
Имеются противопоказания, перед применением необходимо получение консультации специалиста.
Что такое блокатор гистаминовых н1 рецепторов
Л.Р. Селимзянова (1, 2), Е.А. Вишнева (1), Е.А. Промыслова (1)
(1) ФГБУ «Научный центр здоровья детей» РАМН, Москва; (2) ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Минздрава России, Москва
Гистамин – один из важнейших медиаторов, относящийся к биогенным аминам и синтезирующийся из аминокислоты гистидина путем декарбоксилирования в тучных клетках и базофилах. Гистамин принимает участие во многих физиологических и патологических процессах в организме человека.
Действие гистамина осуществляется посредством взаимодействия со специфическими гистаминовыми рецепторами, расположенными на клетках различных тканей. Они относятся к обширному семейству рецепторов, ассоциированных с G-белками (GPCRs – G protein-coupled receptors). Группа GPCRs принимает активное участие в трансмиссии внеклеточных сигналов через клеточную мембрану путем специфического распознавания и связывания разнообразных лигандов, таких как белки, ионы, нейропередатчики и даже световые стимулы (фотоны). GPCRs широко представлены в организме и принимают участие во многих процессах – как физиологических, так и патологических, таких как обоняние, вкус, зрение, когнитивные функции, эмоции, иммунный ответ, в т.ч. аллергия, а также в регуляции деятельности сердечно-сосудистой, нервной, пищеварительной, дыхательной и других систем организма [1].
К настоящему времени описано четыре типа гистаминовых рецепторов (табл. 1), среди которых наиболее изучены H1- и H2-рецепторы.
В развитии аллергии принимают участие в основном H1-гистаминовые рецепторы, однако к настоящему времени накоплены данные о роли H4-гистаминовых рецепторов при иммунопатологических состояниях, в частности при аллергических болезнях [7–9]. Обсуждается возможность применения препаратов, воздействующих на H4-гистаминовые рецепторы при различных заболеваниях, в т.ч. при аллергии [10]. H2-гистаминовые рецепторы также могут участвовать в развитии аллергических проявлений [11, 12].
Интересно, что все GPCRs обладают конститутивной (спонтанной) рецепторной активностью, т.е. их активность проявляется даже в отсутствие агониста и его связи с рецептором [13]. Это наглядно объясняется моделью равновесного состояния рецептора: одновременного существования его спонтанно активных и неактивных форм. Под воздействием различных агентов может происходить нарушение равновесия и смещение в сторону активации (в случае гистаминовых рецепторов – под воздействием гистамина) или, напротив, в сторону неактивного состояния рецептора (при воздействии блокаторов H1-гистаминовых рецепторов). Кроме того, существуют нейтральные агонисты, которые связываются и с активной, и с неактивной формами рецепторов, сохраняя их равновесное состояние. Исходя из вышесказанного, H1-антигистаминные средства, по сути, являются не блокаторами, а обратными агонистами рецепторов, хотя до настоящего времени традиционно сохраняется привычная терминология [1].
Действие гистамина на H1-рецепторы представлено широким разнообразием клинических проявлений:
Гистамину принадлежит одна из ключевых ролей в развитии таких аллергических заболеваний, как атопический дерматит, аллергический ринит, бронхиальная астма, аллергический конъюнктивит, крапивница, а также системных анафилактических реакций [14].
Активация H1-гистаминовых рецепторов сопровождается активацией фосфолипазы C, D и A2 что в итоге приводит к высвобождению ионов кальция Ca2+ и, соответственно, к активации функции клетки. Кроме того, повышается активность ядерного фактора kB (NF-kB), что сопряжено с продукцией провоспалительных цитокинов и молекул межклеточной адгезии, таких как P-селектин, ICAM-1 (Inter-Cellular Adhesion Molecule 1), VCAM-1 (Vascular cell adhesion molecule 1), iNOS, фактора некроза опухоли α (ФНО-α), гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ), интерлейкина-1β (ИЛ-1β), ИЛ-6. Установлено, что NF-kB играет немаловажную роль в активации лимфоцитов; в частности, способствует дифференцировке Т-хелперных клеток 2-го типа, что особенно актуально при аллергических заболеваниях. Повышенный уровень NF-kB обнаруживается у больных различными типами аллергии, в т.ч. бронхиальной астмой [15]. Таким образом, H1-гистаминовые рецепторы не только участвуют в ранней фазе аллергической реакции, но и обладают более широкими иммунологическими свойствами, в т.ч. играют немаловажную роль в развитии поздней фазы аллергического воспаления. Следовательно, противоаллергическое действие антигистаминных препаратов многопланово и включает в т.ч. противовоспалительный эффект [11].
История создания этих лекарственных средств берет начало с 1937 г., когда был синтезирован первый H1-антигистаминный препарат, который не использовался как лекарственное средство ввиду своей токсичности [16]. Клиническое применение антигистаминных средств началось в 1942 г. с препарата антерган, за которым последовали дифенгидрамин (1945), хлорфенирамин, бромфенирамин и прометазин [17]. Восьмидесятые годы двадцатого столетия ознаменовались активным развитием группы антигистаминных средств, включая появление препаратов второй генерации [18].
H1-антигистаминные средства являются препаратами выбора при аллергическом рините, аллергическом конъюнктивите, крапивнице, используются в терапии атопического дерматита, системных аллергических реакций [14, 19, 20].
В настоящее время на фармацевтическом рынке представлено достаточно большое количество H1-антигистаминных средств. Традиционная классификация этих препаратов делит их на две группы: I и II поколений (табл. 2).
Препараты I поколения являются неселективными агонистами H1-гистаминовых рецепторов, нередко проявляя активность в отношении рецепторов других биоактивных аминов, и, соответственно, могут оказывать антихолинергический, анти-α-адренергический и антисеротониновый эффекты. Кроме того, обладая высокой липофильностью, эти препараты хорошо проникают через гематоэнцефалический барьер и взаимодействуют с центральными H1-гистаминовыми рецепторами. Эти свойства обусловливают следующее: H1-антигистаминные средства I поколения часто оказывают седативный эффект (а у ряда больных, напротив, парадоксальное возбуждение), могут вызывать сухость слизистых оболочек, сгущение бронхиального секрета, запор или диарею, тошноту и тахикардию. Хотя надо отметить, что частота подобных эффектов может существенно различаться у разных препаратов и отдельных больных.
Побочные эффекты H1-антиги-стаминных препаратов I поколения могут как носить нежелательный характер, так и быть полезными в ряде клинических ситуаций; например, седация может быть необходимой ряду больных при выраженном кожном зуде. Взаимодействие препаратов с холинергическими рецепторами дополнительно способствует уменьшению зуда и чихания, нередко существенно нарушающих самочувствие больных аллергическим ринитом.
В целях безопасного применения H1-антигистаминных препаратов I поколения врачу следует помнить, что их не следует применять одновременно с антихолинергическими средствами (ингибиторами моноаминооксидазы, синтетическими противосудорожными препаратами, М-холиноблокаторами, нейролептиками, трициклическими антидепрессантами, средствами для лечения паркинсонизма). Соблюдать осторожность больным язвенной болезнью, сердечно-сосудистыми заболеваниями, диабетом, глаукомой [11].
Кроме того, препараты I поколения (клемастин, хлоропирамин) имеют инъекционные лекарственные формы, что делает их незаменимыми при купировании острых аллергических реакций (крапивницы, ангионевротического отека) или для премедикации перед диагностическими и хирургическими вмешательствами [14, 21, 22].
Существенным преимуществом препаратов I поколения остается наличие топических лекарственных форм для интраназального, внутриконъюнктивального и накожного применения (табл. 3).
В настоящее время не рекомендовано широкое использование H1-антигистаминных препаратов I поколения для системного применения, однако их топические формы включены в большинство современных руководств по аллергическому риниту и конъюнктивиту [19, 23]. При применении этих препаратов достигается быстрый (через 15 минут), значимый противоаллергический эффект и практически отсутствуют системные побочные эффекты [21]. Есть исследования, позволяющие предполагать потенциальную противовоспалительную активность топических антигистаминных средств [24].
Единственным H1-антигистамин-ным препаратом накожного применения является диметинден, выпускается он в форме геля и эмульсии, разрешен детям с 1-го месяца. При топическом использовании диметинден проявляет противогистаминное и антикининовое действия, вследствие чего развиваются противозудный и местноанестезирующий эффекты [25]. Таким образом, диметинден можно применять при различных зудящих дерматозах. Вышеперечисленные свойства позволяют использовать накожные формы препарата в лечении солнечных ожогов [26] и при зуде, сопровождающем высыпания при ветряной оспе [27].
Антигистаминные препараты II поколения отличаются селективным воздействием на H1-гистаминовые рецепторы, практически не проникают через гематоэнцефалический барьер, что уменьшает вероятность развития седативного эффекта при их применении. Согласно данным исследований, среди препаратов этой группы при однократном приеме среднетерапевтической дозы связь с центральными H1-гистаминовыми рецепторами менее 0,1 % обнаружена у фексофенадина, при этом в психомоторном тесте эффект этого препарата на ЦНС не отличался от плацебо [28], в то время как цетиризин продемонстрировал связь с H1-гистаминовыми рецепторами в 12,5–25,2 % [29]. Имеются данные, позволяющие предполагать меньшую вероятность развития седативного эффекта у левоцетиризина по сравнению с цетиризином [30] и незначительную – у дезлоратадина [31, 32].
Для антигистаминных препаратов II поколения характерны более высокая аффинность к H1-гистаминовым рецепторам и, соответственно, более длительный эффект по сравнению со средствами I поколения, что позволяет применять большинство из них не чаще одного раза в сутки.
H1-антигистаминные препараты II поколения в настоящее время считаются препаратами выбора при аллергическом рините, крапивнице, других зудящих дерматозах [14, 19, 20, 33–36].
Ряд антигистаминных препаратов проявляет кардиотоксичность: аритмогенную активность вплоть до жизнеугрожающих форм аритмии. В связи с этим во многих странах, в т.ч. и в России, запрещены к применению астемизол и тербинафин. При приеме доз, превышающих среднетерапевтические, удлинение интервала QT на ЭКГ и развитие аритмий возможны у прометазина [37] и дифенгидрамина [38].
Многие антигистаминные средства метаболизируются в печени с участием цитохрома P450, в связи с чем не рекомендован их одновременный прием с ингибиторами этого фермента: ряд противогрибковых препаратов (итраконазол, кетоконазол), многие макролиды, некоторые антидепрессанты, циметидин и др. [11] Печеночному метаболизму не подвергаются цетиризин и левоцетиризин [39]¸ минимально – фексофенадин [40].
Немаловажное значение в педиатрической практике имеет наличие специальных детских лекарственных форм и возраст-разрешенный диапазон применения препаратов.
В настоящее время в России ни один H1-антигистаминный препарат II поколения не разрешен к применению детьми до 6 месяцев. В этой возрастной категории врач может назначать лишь диметинден и хлоропирамин (с 1 месяца), при этом детская лекарственная форма для перорального применения (капли) есть только у диметиндена. Другие препараты, использующиеся в более старшем возрасте и имеющие детские лекарственные формы, включают цетиризин (капли, сироп), ципрогептадин (сироп), левоцетиризин (капли), лоратадин (сироп, суспензия) и дезлоратадин (сироп).
Таким образом, H1-антигистаминные средства в настоящее время представлены широкой линейкой препаратов, которые могут быть использованы в педиатрической практике с учетом возраста ребенка, типа заболевания, особенностей преморбидного фона и сопутствующей патологии.
Литература
Об авторах / Для корреспонденции
Л.Р. Селимзянова – к.м.н., с.н.с. отдела стандартизации и клинической фармакологии ФГБУ НЦЗД РАМН, ассистент кафедры педиатрии и детской ревматологии ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Минздрава России
Е.А. Вишнева – к.м.н., ведущий научный сотрудник отдела стандартизации и клинической фармакологии ФГБУ НЦЗД РАМН
Е.А. Промыслова – научный сотрудник отдела стандартизации и клинической фармакологии ФГБУ НЦЗД РАМН
Современные антигистаминные препараты в лечении аллергических заболеваний
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Н а протяжении 60 лет антигистаминные препараты (АГП) используются в терапии следующих аллергических заболеваний:
• аллергический ринит (сезонный и круглогодичный)
• кожные аллергические заболевания (атопический дерматит, острая и хроническая крапивница, отек Квинке и др.)
• аллергические реакции на укусы и ужаления насекомых
• профилактика осложнений при СИТ и др.
Попытки использовать вновь получаемые антигистаминные препараты шире, чем это логически обосновано, дискредитируют даже те лекарственные средства, эффективность которых для лечения гистаминергических симптомов чрезвычайно высока.
Аллергические заболевания, в частности, аллергический ринит, атопическая астма, хроническая идиопатическая крапивница, атопический дерматит, относятся к числу наиболее распространенных патологических состояний у человека. Хотя эти заболевания обычно не создают угрозы для жизни, тем не менее они могут значительно ухудшить качество жизни больных. Аллергические заболевания имеют сходный патогенез и по сути дела могут рассматриваться, как местные проявления системного аллергического воспаления. Одним из главных медиаторов аллергических реакций является гистамин, поэтому средствами выбора в лечении аллергических заболеваний, прежде всего ринита и хронической крапивницы, остаются блокаторы Н1–гистаминовых рецепторов.
Фармакологические эффекты антигистаминных препаратов I поколения (этаноламины, этилендиамины и др.) определяются их чрезвычайно высокой липофильностью и способностью блокировать рецепторы разных типов:
Фармакологические особенности действия антигистаминных препаратов I поколения дают большой спектр побочных эффектов.
Побочные действия АГП I поколения
Широкий спектр фармакологической активности расширяет возможности их использования не только при аллергических заболеваниях:
Широкий спектр фармакологической активности расширяет возможности их использования не только при аллергических заболеваниях:
Антигистаминные препараты I поколения используют и будут использовать, главное – делать это разумно, учитывая все характеристики этих препаратов. Они существуют в виде раствора, поэтому в тех ситуациях, когда требуется применение растворов, нужно использовать антигистаминные препараты I поколения.
Для лечения хронических заболеваний, требующих длительного применения препаратов, более показано использование антигистаминных препаратов II поколения (лоратадин, цетиризин, эбастин и др.) и их метаболитов, которые в литературе нередко называют препаратами III поколения (фексофенадин, дезлоратадин, норастемизол и др.).
У антигистаминных препаратов II поколения (астемизол, терфенадин) в терапевтических дозах отсутствует седативный эффект, однако при применении их в практике обнаружились осложнения другого рода.
Начиная с 1986 г., в ряде публикаций дано описание удлинения интервала QT и трепетания–мерцания желудочков сердца, связанных с применением астемизола. Пациенты отрицали факт превышения дозы препарата, однако уровни его в плазме и кинетика выведения четко указывали на передозировку.
Воздействие на деятельность сердца также описывалось у терфенадина, примененного в комбинации с кетоконазолом или эритромицином. Это обусловлено повышением концентрации терфенадина в плазме под действием вышеперечисленных препаратов, ингибирующих цитохром Р450.
Использование этих препаратов в терапевтических дозах вызывало нарушения сердечного ритма (кардиотоксический эффект), что связано с особенностями их метаболизма и фармакокинетики. Антигистаминное действие осуществляется за счет активных метаболитов, которые образуются в печени при участии ферментов системы цитохрома P450. Макролиды и противогрибковые препараты обладают способностью ингибировать активность этого фермента, следствием чего является накопление исходного препарата в крови и ткани сердца, что приводит к нарушениям сердечного ритма. Не исключена возможность этих осложнений и при применении эбастина.
Кроме того, к факторам риска развития аритмий при приеме АГП относят: нарушение функций печени, злоупотребление алкоголем, электролитные нарушения, заболевания сердца, одновременное использование противоаритмических и психотропных средств.
Лоратадин, метаболизирующийся двумя изоферментами системы цитохрома Р450, подобных осложнений лишен. Лоратадин не имеет отрицательного влияния на деятельность сердца, что является бесспорным преимуществом этого препарата.
Метаболиты антигистаминных препаратов II поколения (фексофенадин, дезлоратадин, норастемизол и др.) при отсутствии седативного, кардиотоксического и других нежелательных эффектов имеют значительно лучший профиль безопасности.
Однако АГП подавляют не все симптомы аллергии, например, они оказывают небольшое влияние на заложенность носа у больных сезонным аллергическим ринитом и малоэффективны при атопической астме. Это не удивительно, так как препараты этой группы действуют лишь на один компонент аллергического каскада, что определяет необходимость разработки новых, более эффективных противоаллергических средств. Ниже обсуждаются механизмы действия и результаты клинических исследований дезлоратадина (Эриус), который не только селективно блокирует Н1–гистаминовые рецепторы, но и обладает выраженной противоаллергической и противовоспалительной активностью за счет подавления различных элементов раннего и позднего аллергического ответа.
Дезлоратадин – активный метаболит лоратадина, хорошо известного селективного блокатора Н1–гистаминовых рецепторов II поколения. Дезлоратадин обладает сходными фармакодинамическими свойствами, однако по активности превосходит лоратадин (в 2,5–4 раза) и другие препараты этой группы. В экспериментальных исследованиях антигистаминные средства располагались в следующем порядке по сродству к Н1–гистаминовым рецепторам (по убыванию): дезлоратадин > хлорфенирамин > гидроксизин > мизоластин > терфенадин > цетиризин > эбастин > лоратадин > фексофенадин [2,11]. In vitro дезлоратадин обладает значительно менее выраженным сродством к Н2– и мускариновым рецепторам, чем к Н1–рецепторам [15,16]. Селективность препарата подтверждают и результаты плацебо–контролируемых фармакологических и клинических исследований, в которых дезлоратадин не вызывал антихолинергических симптомов, таких как сухость во рту и нарушение зрения [11].
Доклинические исследования показали, что дезлоратадин ингибирует многие медиаторы, принимающие участие в развитии системного аллергического воспаления, включая цитокины и хемокины, а также молекулы адгезии. Например, дезлоратадин снижал выброс гистамина, триптазы, лейкотриена С4 и простагландина D2 тучными клетками и базофилами in vitro [8,11,14], стимулированную секрецию тучными клетками человека интерлейкинов 3 и 4, фактора некроза опухоли a и гранулоцитарно–макрофагального колониестимулирующего фактора [19], секрецию интерлейкина–8 тучными клетками, базофилами и эндотелиальными клетками [20,23], и высвобождение RANTES в препаратах эпителия полипов носа [18], активность молекул адгезии, в том числе Р–селектина и ICAM–1, in vitro [23,25]. Недавно опубликованы данные о подавляющем действии препарата на хемотаксис и активацию эозинофилов in vitro и образование супероксидного радикала [1]. Таким образом, дезлоратадин обладает широким спектром противоаллергической и противовоспалительной активности, что должно способствовать повышению его эффективности при лечении аллергических заболеваний.
У здоровых людей дезлоратадин метаболизируется главным образом, путем глюкуронирования с образованием 3–ОН формы. Фармакокинетика дезлоратадина линейная и пропорциональна дозе. Период его полувыведения составляет 21–24 ч, что позволяет назначать этот препарат один раз в сутки. У больных с нарушением функции печени Cmax и AUC дезлоратадина были значительно выше, чем у здоровых людей, хотя концентрация препарата не превышала таковую при применении дезлоратадина в высокой дозе (45 мг/сут) в течение 10 дней. В более низкой терапевтической дозе 5 мг/сут дезлоратадин, вероятно, безопасен для больных с нарушенной функцией печени.
Прием пищи может оказать нежелательное влияние на скорость и степень всасывания лекарственных веществ. Фармакокинетика и биодоступность дезлоратадина были сходными при приеме препарата натощак или после стандартизированной пищи у здоровых людей (Cmax натощак и после еды составила 3,3 и 3,53 нг/мл соответственно, р=0,17) [9]. Таким образом, дезлоратадин можно принимать как после еды, так и натощак.
Сезонный аллергический ринит
Сезонный аллергический ринит
Одно из главных показаний к применению блокаторов Н1–гистаминовых рецепторов – аллергический ринит. Эффективность дезлоратина в дозе 5 мг 1 раз в сутки у больных сезонным аллергическим ринитом изучалась в 4 рандомизированных, двойных слепых, плацебо–контролируемых исследованиях [22,24,25,30]. В эти исследования включали больных старше 12 лет, у которых имелись среднетяжелый и тяжелый сезонный аллергический ринит, по крайней мере, двухлетний анамнез поллиноза, положительная кожная проба на сезонный аллерген в течение предыдущего года и отсутствовали анатомические изменения носа. В течение 3–4-х дней вводного периода и во время лечения больные оценивали выраженность различных симптомов ринита по 4–балльной шкале (0 – нет, 3 – выраженный). До приема утренней дозы пациенты давали оценку симптомам, которая отражает эффект препарата в конце интервала дозирования (действие некоторых лекарственных средств может оказаться неполным в течение этого интервала). Кроме того, утром и вечером больные оценивали выраженность симптома за предыдущие 12 ч. Затем определяли среднее значение полученных индексов. Критерием эффективности была динамика индексов отдельных симптомов и суммарного индекса симптомов.
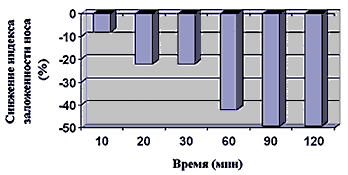
Во всех исследованиях дезлоратадин по эффективности достоверно превосходил плацебо и уменьшал все симптомы ринита (ринорею, зуд, чихание и т.д.). Особый интерес представляют результаты изучения деконгестивного действия дезлоратадина при аллергическом рините. АГП, как правило, слабо влияют на заложенность носа, поэтому в клинических исследованиях этот симптом обычно даже не учитывается при расчете суммарного индекса симптомов. Лечение дезлоратадином привело к значительному уменьшению индекса заложенности носа (по сравнению с плацебо) в течение нескольких часов после приема первой дозы, и деконгестивный эффект сохранялся на протяжении всего исследования (15–28 дней). F.Horak и соавт. [12] использовали специальную камеру, позволяющую провести контролируемую провокацию аллергеном, для оценки эффектов дезлоратадина на симптомы сезонного аллергического ринита. Медиана времени до уменьшения симптомов составила 48,5 мин, что указывало на быстрый эффект первой дозы. У всех 28 пациентов, подвергавшихся действию аллергена в течение 4 ч на 1–й и 4–й дни применения дезлоратадина, отмечено уменьшение суммарных индексов симптомов по крайней мере на 25% в течение 160 мин, а у 19 (68%) – в течение 60 мин. У больных, у которых суммарный индекс симптомов уменьшился, по крайней мере, на 2 балла, средний индекс заложенности носа уменьшился почти на 10% через 10 мин, на 22% через 20–30 мин, на 40% через 60 мин и почти на 50% через 90–120 мин (рис.1).
Рис. 1. Снижение индекса заложенности носа при применении дезлоратадина
Таким образом, дезлоратадин оказался единственным блокатором Н1–гистаминовых рецепторов, который в контролируемых исследованиях давал постоянный деконгестивный эффект. Этот эффект проявлялся в течение нескольких минут или часов после приема первой дозы и сохранялся до 4 недель. Напротив, в сходных двойных слепых плацебо–контролируемых рандомизированных исследованиях других антигистаминных препаратов, таких как цетиризин (5–10 мг 1 раз в сутки), признаков деконгестивного действия не выявлено [13,28] или оно было непостоянным. Деконгестивный эффект дезлоратадина имеет важное клиническое значение. Обструкцией носа страдают 47–64% больных сезонным и круглогодичным аллергическим ринитом [34], почти в два раза повышен риск нарушений дыхания во время сна [37]. Кроме того, отечность и воспаление слизистой оболочки носа могут ограничить всасывание других лекарственных средств [21]. Больные, страдающие заложенностью носа, чаще дышат через рот, что может способствовать ингаляции аллергенов и прогрессированию ринита [5]. Следует отметить, что обструкция носа связана с воспалительными изменениями слизистой оболочки носовой полости, которые возникают в результате повышения секреции различных провоспалительных медиаторов. Соответственно, деконгестивное действие дезлоратадина подтверждает тот факт, что его эффект нельзя объяснить только блокадой Н1–гистаминовых рецепторов.
В нескольких многоцентровых рандомизированных двойных слепых плацебо–контролируемых исследованиях изучалась эффективность дезлоратадина у больных сезонным аллергическим ринитом, сочетавшимся с бронхиальной астмой [4,26]. Критериями включения в эти исследования были наличие сезонного аллергического ринита и астмы в течение по крайней мере 2 лет, применение только агонистов b2–адренорецепторов по потребности, объем форсированного выдоха за 1 с (ОФВ1) і 70% от должного и положительная кожная проба на сезонный аллерген в течение года до начала исследования. Из исследований исключали больных, получавших кортикостероиды, антигистаминные средства или деконгестанты в любых формах, пользовавшихся сальбутамолом более 12 раз в сутки, а также пациентов, страдавших другими серьезными заболеваниями. Все 4–недельные исследования предполагали 3–4–дневный вводный период, во время которого больные оценивали исходную выраженность симптомов по 4–балльной шкале (0 – нет, 3 – выраженный). Симптомы оценивали в конце интервала дозирования перед приемом утренней дозы (т.е. в конце действия препарата). Кроме того, утром и вечером оценивали выраженность симптомов за предыдущие 12 ч и определяли среднее значение двух индексов. Исследования проводили во время сезона аллергии.
У 311 больных сезонным аллергическим ринитом/ астмой терапия дезлоратадином 1 раз в сутки привела к значительному уменьшению симптомов ринита. В группе дезлоратадина суммарный индекс симптомов ринита за предыдущие 12 ч снизился по сравнению с исходным на 31–35% на 1–2 неделе и 1–4 неделе соответственно, а в группе плацебо – на 20–25% (р Заключение
Дезлоратадин (Эриус) – мощный и селективный блокатор Н1–гистаминовых рецепторов, по фармакологической активности превосходящий другие препараты этой группы. Дезлоратадин дает не только антигистаминный эффект, но и блокирует многие другие медиаторы, участвующие в развитии системного аллергического воспаления, т.е. оказывает противоаллергическое и противовоспалительное действие. Важным достоинством препарата является удобная схема применения (один раз в сутки).
В двойных слепых плацебо–контролируемых рандомизированных исследованиях доказана эффективность дезлоратадина в дозе 5 мг один раз в сутки у больных сезонным аллергическим ринитом и хронической идиопатической крапивницей, которые являются основными показаниями к назначению Н1-блокаторов. В отличие от других АГП II поколения, у больных сезонным аллергическим ринитом дезлоратадин уменьшал не только чихание, ринорею и зуд, но и заложенность носа. Продемонстрирована также эффективность дезлоратадина у больных с сочетанием аллергического ринита и атопической астмы.
Дезлоратадин хорошо переносится, не вызывает сонливости и удлинения интервала QT на ЭКГ. Безопасность дезлоратадина подтверждает многолетний опыт применения лоратадина, активным метаболитом которого он является.
1. Agrawal D., Berro A., Townely R. Desloratadine attenuation of eosinophil chemotaxis, adhesion, and superoxide generation. Allergy,. 2000, 55 (suppl. 63), S276, Abstract 990.
2. Anthes J., Richard C., West R. et al. Functional characteristics of desloratadine and other anhistamines in human Yl receptors. Allergy, 2000, 55 (suppl. 63), S279 (Abstract 994).
3. Baena–Cagnani C. and the Desloratadine Study Group. Desloratadine improved asthma symptoms and decreased beta2–agonist use in patents with seasonal allergic rhinitis and concomitant asthma. XXth Congress of Europ. Academy of Allergology and Clinical Immunology, Berlin, 2001.
4. Baena–Cagnani C. Desloratadine activity in concurrent seasonal allergic rhinitis and asthma. Allergy, 2001, 56 (suppl. 65), 21–27.
5. Corren J. Allergic rhinitis and asthma: how important is the link? J. Allergy Clin. Immunol., 1997, 99, S781–S786.
6. DuBuske L. Second–generation antihistamies: the risk of ventricular arrhythmias. Clin. Ther., 1999, 21 (2), 281–285.
7. Geha R., Meltzer E. Desloratadine: a new, nonsedating, oral antihistamine. J. Allergy Clin. Immunol., 2001, 107 (4), 751–762.
8. Genovese A., Patella V., De Crcsccnzo G. ct al. Loratadine and desethoxycar–bonyl–loratadine inhibit the immunological release of mediators from human Fc epsilon R1+ cells. Clin. Exp. Allergy, 1997, 27, 559–567.
9. Gupta S., Banfield C., Kantesaria B. et al. Pharmacokinetic and safety profile of desloratadine and fexofenadine when coadministered with azithromycin: a randomized, placebo–controlled, parallel–group study. Clin. Ther., 2001, 23 (3), 451–466.
10. Gupia S., Padhi d., Banfield C. el al. The oral bioavailabuity of desloratadine is unaffected by food. Allergy, 2000, 55 (suppl. 63), Abstract 959.
11. Henz B. The pharmacological profile of desloratadie: a review. Allergy, 2001, 56 (suppl. 65), 7–13.
12. Horak F., Stubner U., Zieglmayer R. et al. Onset and duration of action of desloratadine. XIX Congress of Europ. Academy of Allergology and Clinical Immunology, Lisbon, 2000.
13. Howarth P., Stem M., Roi L. et al. Double–blind, placebo–controlled study comparing the efficacy and safety of fexofenadine hydrochloride (120 and 180 mg once daily) and cetirizine in seasonal allergic rhinitis. J. Allergy Clin. Immunol., 1999, 104, 927–933.
14. Kleine–Tebbe J., Josties C., Frank G. et ai. Inhibition of IgE–mediated and IgE–independent histamine release from human basophil leukocytes in vitro by Hl–antagonist, descarbo–ethoxyloratadine. J. Allergy Clin. Immunol., 1994, 93, 494–500.
15. Kreutner W., Hey J., Anthes J. et al. Preclinical pharmacology of desloratadine, a selective and nonsedating histamine HI receptor antagonist, 1st communication: receptor selectivity, antihistaminic activity, and antiallergic effects. Arzneimittelforschung, 2000, 50, 345–352.
16. KLreutner W., Hey J., Anthes J. et al. Preclinical studies of desloratadine, a nonsedating, selective histamine HI receptor antagonist with antiallergic activity. Allergy, 2000, 55 (suppl. 63), S278 (Abstract 997).
17. Kreutner W., Hey J., Chiu P., Barnett A. Preclinical pharmacology of desloratadine, a selective and nonsedating histamine HI–receptor antagonist, 2nd communication: lack of central nervous system and cardiovascular effects. Arzneimittelfoschung. 2000, 50 (5), 441–448.
18. Lebel B., Bousquet J., Czarlewski W., CampbcU A. Loratadine reduces RANTES release by an epithelial cell line. J. Allergy Clin. Tmmunol., 1997, 99, (S444), Abstract 1802.
19. Lippert U., Moller A., Welker P. et al. Inhibition of cytokine secretion from human leukemic mast cells and basophils by HI– and H2–receptor antagonists. Exp. Dermatol., 2000, 9, 118–124.
20. Lippert U., Kruger–Krasagakes S., Moller A. el al. Pharmacological modulation of IL–6 and IL–8 secretion by the HI–antagonist descarboethoxy–loratadine and dex–amethasone by human mast and basophilic cell lines. Exp. Dermatol., 1995, 4, 272–276.
21. Lipworth B., Jackson C. Safety of inhaled and intranasal corticosteroids: lessons for the new millenium. Drug Saf., 2000, 23, 11–33.
23. Molet S., Gosset P., Lasalle P. et al. Inhibitory activity of loratadine and descar–boxyethoxyloratadine on histamine–induced activation of endothelial cells. Qm Exp. Allergy, 1997, 27, 1167–1174.
24. Nathan R. and the Desloradine Study Group. Desloratadine relieved nasal congestion in patients with seasonal allergic rhinitis. Annual meeting of American College of Allergy, Asthma and Immunology, Seattle, 2000.
25. Nayak A., Lorber R., Salmun L. Decongestant effects of desloratadine in patients with seasonal allergic rhinitis. J. Allergy Clin. Immunol., 2000, 105 (1) Abstract 1122.
26. Norman P., Dimmann A., Rabasseda. Desloratadine: a preclinical and clinical overview. Drugs Today, 2001, 37 (4), 215–227.
27. O’Doj^iell B., Lawlor R., Simpson J. el al. The impact of chronic urticaria on the quality of life. Br. J. Dermatol., 1997, 136, 197–201.
28. Pearlman D., Lumry W., Winder J., Noonan M. Once–daily cetirizine effective in the treatment of seasonal allergic rhinitis: a randomized, double–blind, placebo–controlled study. Clin. Pediatr. (Phila), 1997, 36. 209–215.
29. Pedersen P., Weeke E. Asthma and allergic rhinitis in the same patients. Allercv, 1983, 38, 25–29.
30. Premier B. and the Desloratadine Study Group. Desloratadine once daily reduces nasal congestion in patients with seasonal allergic rhinitis, 17th Int. Congress of Allergology and Clinical Immunology, Sydney, 2000.
31. Ratner P. and the Desloratadine Study Group. Desloratadine improved ASTHMA symptoms and reduced bronchodilatator use in 2 studies of patients with asthma and SAR. Ann. Meeting of American College of Allergy, Asthma in4 Immunology, Seattle, 2000.
33. Schenkel E. and the Desloratadine Study Group. Desloratadine improved SAR symptoms in patients with mild–to–moderate asthma and SA–R. Ann. Meeting of American College of Allergy, Asthma and Immunology, Seattle, 2000.
34. Sibbald B., Rink E. Epidemiology of seasonal and perennial rhinitis: clinical presentation and medical history. Thorax, 1991, 46, 895–901.
35. Vignota A., Crampette L., Mondain M. et al. Inhibitory activity of loratadine and descarboethoxyloratadine on expression of ICAM–1 and HLA–DR by nasal epithelial cells. Allergy, 1995, 50, 200–203.
36. Worldwide variation in prevalence of symptoms of asthma, allergic rhinoconjunc–tivitis and atopic eczema: ISSAC– International Study of Asthma and Allergies in Childhood Steering Committee. Lancety. 1998, 351 (9111), 1225–1232.
37. Young T., Finn L., Kom H. et al. Nasal obstruction as a risk factor for sleep–disordered breathing. J. Allergy Clin. Tmmunol., 1997, 99, S757–S762.