Что такое биополимеры в биологии 9 класс определение
Биополимеры
Полезное
Смотреть что такое «Биополимеры» в других словарях:
БИОПОЛИМЕРЫ — высокомолекулярные (молекулярная масса 103 109) природные соединения белки, нуклеиновые кислоты, полисахариды, а также их производные. Являются структурной основой живых организмов и играют определяющую роль в процессах жизнедеятельности … Большой Энциклопедический словарь
БИОПОЛИМЕРЫ — высокомолекулярные (мол. м. 10л 109) природные соединения белки, нуклеиновые к ты, полисахариды, молекулы которых состоят из большого числа повторяющихся групп атомов или звеньев одинакового или различного химич. строения. Составляют структурную… … Биологический энциклопедический словарь
биополимеры — природные высокомолекулярные соединения (мол. масса 1°3 1°9 Да), являющиеся структурной основой всех живых клеток и играющие определяющую роль в процессах жизнедеятельности. К Б. относят белки, нуклеиновые кислоты, полисахариды, липиды, а также… … Словарь микробиологии
Биополимеры — класс полимеров, встречающихся в природе в естественном виде, входящих в состав живых организмов: белки, нуклеиновые кислоты, полисахариды. Источник: ВП П8 2322. Комплексная программа развития биотехнологий в Российской Федерации на период до… … Официальная терминология
Биополимеры — БИОПОЛИМЕРЫ, высокомолекулярные (молекулярная масса 103 109) природные соединения белки, нуклеиновые кислоты, полисахариды, а также их производные. Образуют структурную основу клеток, тканей, органов всех живых организмов и играют определяющую… … Иллюстрированный энциклопедический словарь
биополимеры — Термин биополимеры Термин на английском biopolymers Синонимы Аббревиатуры Связанные термины активный центр катализатора, антитело, белки, биоинженерия, биологическая мембрана, биосенсор, доставка лекарственных средств Определение… … Энциклопедический словарь нанотехнологий
Биополимеры — Биополимеры класс полимеров, встречающихся в природе в естественном виде, входящие в состав живых организмов: белки, нуклеиновые кислоты, полисахариды, лигнин. Биополимеры состоят из одинаковых (или схожих) звеньев мономеров. Мономеры … Википедия
биополимеры — ов; мн. (ед. биополимер, а; м.). Высокомолекулярные природные соединения (белки, нуклеиновые кислоты, некоторые углеводы), определяющие важнейшие процессы жизнедеятельности организма. ◁ Биополимерный, ая, ое. * * * биополимеры высокомолекулярные… … Энциклопедический словарь
биополимеры — (см. био. + полимеры) природные высокомолекулярные соединения, являющиеся структурной основой всех живых организмов и играющие определяющую роль в процессах жизнедеятельности; к биополимерам относятся белки, нуклеиновые кислоты, полисахариды и… … Словарь иностранных слов русского языка
биополимеры — biopolimerai statusas T sritis chemija apibrėžtis Biologiškai svarbūs gamtiniai stambiamolekuliai junginiai (baltymai, polisacharidai, nukleorūgštys). atitikmenys: angl. biopolymers rus. биополимеры … Chemijos terminų aiškinamasis žodynas
биополимеры — (био + полимеры) высокомолекулярные соединения биологического происхождения, молекулы которых представляют собой цепочки, образованные из большого числа повторяющихся групп атомов; к Б. относят белки, нуклеиновые кислоты и полисахариды … Большой медицинский словарь
БИОПОЛИМЕРЫ
Полезное
Смотреть что такое «БИОПОЛИМЕРЫ» в других словарях:
БИОПОЛИМЕРЫ — высокомолекулярные (молекулярная масса 103 109) природные соединения белки, нуклеиновые кислоты, полисахариды, а также их производные. Являются структурной основой живых организмов и играют определяющую роль в процессах жизнедеятельности … Большой Энциклопедический словарь
биополимеры — природные высокомолекулярные соединения (мол. масса 1°3 1°9 Да), являющиеся структурной основой всех живых клеток и играющие определяющую роль в процессах жизнедеятельности. К Б. относят белки, нуклеиновые кислоты, полисахариды, липиды, а также… … Словарь микробиологии
Биополимеры — класс полимеров, встречающихся в природе в естественном виде, входящих в состав живых организмов: белки, нуклеиновые кислоты, полисахариды. Источник: ВП П8 2322. Комплексная программа развития биотехнологий в Российской Федерации на период до… … Официальная терминология
Биополимеры — БИОПОЛИМЕРЫ, высокомолекулярные (молекулярная масса 103 109) природные соединения белки, нуклеиновые кислоты, полисахариды, а также их производные. Образуют структурную основу клеток, тканей, органов всех живых организмов и играют определяющую… … Иллюстрированный энциклопедический словарь
биополимеры — Термин биополимеры Термин на английском biopolymers Синонимы Аббревиатуры Связанные термины активный центр катализатора, антитело, белки, биоинженерия, биологическая мембрана, биосенсор, доставка лекарственных средств Определение… … Энциклопедический словарь нанотехнологий
Биополимеры — Биополимеры класс полимеров, встречающихся в природе в естественном виде, входящие в состав живых организмов: белки, нуклеиновые кислоты, полисахариды, лигнин. Биополимеры состоят из одинаковых (или схожих) звеньев мономеров. Мономеры … Википедия
биополимеры — ов; мн. (ед. биополимер, а; м.). Высокомолекулярные природные соединения (белки, нуклеиновые кислоты, некоторые углеводы), определяющие важнейшие процессы жизнедеятельности организма. ◁ Биополимерный, ая, ое. * * * биополимеры высокомолекулярные… … Энциклопедический словарь
биополимеры — (см. био. + полимеры) природные высокомолекулярные соединения, являющиеся структурной основой всех живых организмов и играющие определяющую роль в процессах жизнедеятельности; к биополимерам относятся белки, нуклеиновые кислоты, полисахариды и… … Словарь иностранных слов русского языка
биополимеры — biopolimerai statusas T sritis chemija apibrėžtis Biologiškai svarbūs gamtiniai stambiamolekuliai junginiai (baltymai, polisacharidai, nukleorūgštys). atitikmenys: angl. biopolymers rus. биополимеры … Chemijos terminų aiškinamasis žodynas
биополимеры — (био + полимеры) высокомолекулярные соединения биологического происхождения, молекулы которых представляют собой цепочки, образованные из большого числа повторяющихся групп атомов; к Б. относят белки, нуклеиновые кислоты и полисахариды … Большой медицинский словарь
Огромное количество разнообразных соединений различной химической природы сумел синтезировать человек в лабораторных условиях. Однако все равно самыми важными и значимыми для жизни всех живых систем были, есть и останутся именно естественные, природные вещества. То есть те молекулы, которые участвуют в тысячах биохимических реакций внутри организмов и отвечают за их нормальное функционирование.
Подавляющее большинство из них относится к группе, имеющей название «биологические полимеры».
Общее понятие о биополимерах
Биополимеры клетки
Их достаточно много. Так, основными биополимерами являются следующие:
Помимо них, сюда же можно отнести и многие смешанные полимеры, формирующиеся из комбинаций уже перечисленных. Например, липопротеины, липополисахариды, гликопротеины и другие.
Общие свойства
Можно выделить несколько особенностей, которые присущи всем рассматриваемым молекулам. Например, следующие общие свойства биополимеров:
Но в целом у всех биополимеров все же больше отличий в строении и функциях, нежели сходств.
Белки
В состав молекулы белка может входить очень много аминокислотных остатков, как одинаковых, так и разных (несколько десятков тысяч и более). Всего разновидностей аминокислот, встречающихся в составе данных соединений, насчитывается 20. Однако их разнообразное сочетание позволяет белкам процветать в количественном и видовом отношении.
Биополимеры белков имеют разные пространственные конформации. Так, каждый представитель может существовать в виде первичной, вторичной, третичной или четвертичной структуры.
Вторичная конформация отличается более сложным строением, так как общая макроцепь белка начинает спирализоваться, формируя витки. Две рядом расположенные макроструктуры удерживаются друг возле друга за счет ковалентных и водородных взаимодействий между группировками их атомов. Различают альфа и бета-спирали вторичной структуры белков.
Третичная структура представляет собой свернутую в клубок одну макромолекулу (полипептидную цепь) белка. Очень сложная сеть взаимодействий внутри данной глобулы позволяет ей быть достаточно стабильной и держать принятую форму.
Функции белковых молекул
Если рассматривать белки более углубленно, то можно выделить еще некоторые второстепенные функции. Однако перечисленные являются основными.
Нуклеиновые кислоты
По своей химической природе ДНК и РНК представляют собой последовательности нуклеотидов, соединенных водородными связями и фосфатными мостиками. В состав ДНК входят такие нуклеотиды, как:
Благодаря особой структурной организации молекулы ДНК способны выполнять ряд жизненно значимых функций. РНК также играет в клетке большую роль.
Функции таких кислот
Полисахариды
Значение различных представителей
Очень важны такие биологические полимеры, как крахмал, целлюлоза, инулин, гликоген, хитин и другие. Именно они и являются важными источниками энергии в живых организмах.
Смешанные биополимеры в составе живых существ
Каждый из этих биополимеров имеет множество разновидностей, выполняющих в живых существах ряд важных функций: транспортную, сигнальную, рецепторную, регуляторную, ферментативную, строительную и многие другие. Структура их химически очень сложна и далеко не для всех представителей расшифрована, поэтому и функции до конца не определены. На сегодня известны только самые распространенные, однако значительная часть остается за границами человеческих познаний.
Биополимеры
Высокомолекулярные природные соединения, являющиеся структурной, основой всех живых организмов и играющие определяющую роль в процессах жизнедеятельности. К Б. относятся белки, нуклеиновые кислоты и полисахариды; известны также смешанные Б. — гликопротеиды, липопротеиды, гликолипиды и др.
Биологические функции Б. Нуклеиновые кислоты выполняют в клетке генетические функции. Последовательность мономерных звеньев (нуклеотидов) в дезоксирибонуклеиновой кислоте — ДНК (иногда в рибонуклеиновой кислоте — РНК) определяет (в форме генетического кода (См. Генетический код)) последовательность мономерных звеньев (аминокислотных остатков) во всех синтезируемых белках и, т. о., строение организма и протекающие в нём биохимические процессы. При делении каждой клетки обе дочерние клетки получают полный набор генов благодаря предшествующему самоудвоению (репликации (См. Репликация)) молекул ДНК. Генетическая информация с ДНК переносится на РНК, синтезируемую на ДНК как на матрице (Транскрипция). Эта т. н. информационная РНК (и-РНК) служит матрицей при синтезе белка, происходящем на особых органоидах клетки — рибосомах (Трансляция) при участии транспортной РНК (т-РНК). Биологическая изменчивость, необходимая для эволюции, осуществляется на молекулярном уровне за счёт изменений в ДНК (см. Мутация).
Белки выполняют в клетке ряд важнейших функций. Белки-ферменты осуществляют все химические реакции обмена веществ в клетке, проводя их в необходимой последовательности и с нужной скоростью. Белки мышц, жгутиков микробов, клеточных ворсинок и др. выполняют сократительную функцию, превращая химическую энергию в механическую работу и обеспечивая подвижность организма в целом или его частей. Белки — основной материал большинства клеточных структур (в т. ч. в специальных видах тканей) всех живых организмов, оболочек вирусов и фагов. Оболочки клеток являются липопротеидными мембранами, Рибосомы построены из белка и РНК и т.д. Структурная функция белков тесно связана с регуляцией поступления различных веществ в субклеточные органеллы (Активный транспорт ионов и др.) и с ферментативным катализом. Белки выполняют и регуляторные функции (Репрессоры), «запрещая» или «разрешая» проявление того или иного гена. В высших организмах имеются белки — переносчики тех или иных веществ (например, гемоглобин — переносчик молекулярного кислорода) и иммунные белки, защищающие организм от чужеродных веществ, проникающих в организм (см. Иммунитет). Полисахариды выполняют структурную, резервную и некоторые другие функции. Белки и нуклеиновые кислоты образуются в живых организмах путём матричного ферментативного Биосинтеза. Имеются теперь и биохимические системы внеклеточного синтеза Б. с помощью ферментов, выделенных из клеток. Разработаны методы химического синтеза белков и нуклеиновых кислот.
Первичная структура Б. Состав и последовательность мономерных звеньев Б. определяют их т. н. первичную структуру. Все нуклеиновые кислоты являются линейными гетерополимерами — сахарофосфатными цепочками, к звеньям которых присоединены боковые группы — азотистые основания: аденин и тимин (в РНК — урацил), гуанин и цитозин; в некоторых случаях (главным образом в т-РНК) боковые группы могут быть представлены другими азотистыми основаниями. Белки — также гетерополимеры; молекулы их образованы одной или несколькими полипептидными цепочками, соединёнными дисульфидными мостиками. В состав полипептидных цепей входит 20 видов различных мономерных звеньев — остатков аминокислот. Молекулярная масса ДНК варьирует от нескольких млн. (у мелких вирусов и бактериофагов) до ста млн. и более (у более крупных фагов); бактериальные клетки содержат по одной молекуле ДНК с молекулярной массой в несколько млрд. ДНК высших организмов может иметь и большую молекулярную массу, но измерить её пока не удалось из-за разрывов в молекулах ДНК, возникающих при их выделении. Рибосомные РНК имеют молекулярную массу от 600 тыс. до 1,1 млн., информационная (и-РНК) — от сотен тысяч до нескольких миллионов, транспортная (т-РНК) — около 25 тыс. Молекулярная масса белков варьирует от 10 тыс. (и менее) до миллионов; в последнем случае, однако, обычно возможно разделение белковой частицы на субъединицы, соединённые между собой слабыми, большей частью гидрофобными, связями.
Конформация, т. е. та или иная пространственная форма молекул Б., определяется их первичной структурой. В зависимости от химического строения и внешних условий молекулы Б. могут находиться либо в одной или в нескольких преимущественных конформациях (обычно встречающиеся в природных условиях нативные состояния Б.: например, глобулярное строение белков, двойная спираль ДНК), либо принимать многие более или менее равновероятные конформации. Белки делят по пространственной структуре на фибриллярные (нитевидные) и глобулярные; белки-ферменты, белки-переносчики, иммунные и некоторые другие имеют, как правило, глобулярную структуру. Для ряда белков — гемоглобин, миоглобин, лизоцим, рибонуклеаза и др. — эта структура установлена во всех деталях (с определением при помощи рентгеноструктурного анализа расположения каждого атома). Она определяется последовательностью аминокислотных остатков и образуется и поддерживается относительно слабыми взаимодействиями между мономерными звеньями полипептидных цепей в водно-солевом растворе (кулоновские и дипольные силы, водородные связи, гидрофобные взаимодействия), а также дисульфидными связями. Глобула белка формируется так, что большинство полярных гидрофильных аминокислотных остатков оказывается снаружи и контактирует с растворителем, а большинство неполярных (гидрофобных) остатков находится внутри и изолировано от взаимодействия с водой. Молекулы белка, обладающие избытком неполярных групп, когда часть из них оказывается на поверхности глобулы, образуют высшую, т. н. четвертичную структуру, при которой несколько глобул агрегируют, взаимодействуя между собой в основном неполярными участками (рис. 1). Пространственная структура каждого белка-фермента уникальна и обеспечивает необходимое для его функционирования расположение в пространстве всех звеньев Б., в особенности т. н. активных центров (См. Активные центры). В то же время она не абсолютно жестка и допускает необходимые в процессе функционирования (при взаимодействии с субстратами, ингибиторами и другими веществами) конформационные сдвиги и изменения.
Пространственная структура нативной ДНК образована двумя комплементарными нитями и представляет собой двойную спираль Крика — Уотсона; в ней противоположные азотистые основания попарно связаны водородными связями — аденин с тимином и гуанин с цитозином. Устойчивость двойной спирали обеспечивается, наряду с водородными связями, также гидрофобным взаимодействием между плоскими кольцами азотистых оснований, расположенных стопкой (стопочное взаимодействие, или стакинг). Нити РНК спирализованы лишь частично. ДНК вирусов, бактериофагов, бактерий, а также митохондриальная в ряде случаев представляет собой замкнутое кольцо; при этом наряду со спиралью Крика — Уотсона наблюдается ещё дополнительная т. н. сверхспирализация.
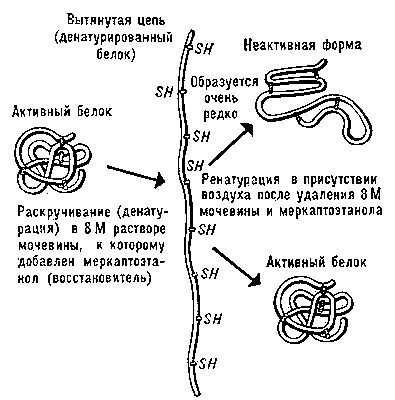
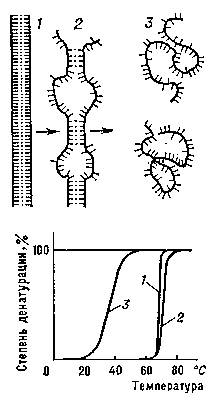
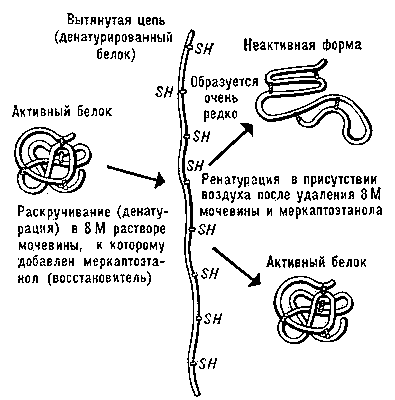
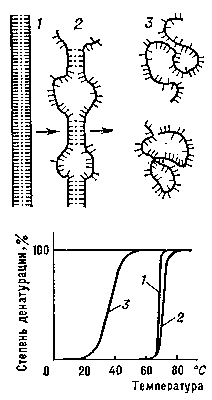
Денатурация Б. Нарушение нативной пространственной структуры Б. при различных воздействиях (повышение температуры, изменение концентрации металлов, кислотности раствора и др.) называется денатурацией и в ряде случаев обратимо (обратный процесс называется ренатурацией; рис. 2). Молекулы Б. — кооперативные системы: поведение их зависит от взаимодействий составляющих частей. Кооперативность молекул Б. определяется тем, что повороты отдельных звеньев из-за внутримолекулярных взаимодействии зависят от конформации соседних звеньев. В основе денатурации Б. при изменении внешних условий обычно лежат кооперативные конформационные превращения (например, переходы α-спираль — β-структура, α-спираль — клубок, β-структура — клубок для полипептидов, переход глобула — клубок для глобулярных белков, переход спираль — клубок для нуклеиновых кислот). В отличие от фазовых переходов (кипение жидкости, плавление кристалла), являющихся предельным случаем кооперативных процессов и происходящих скачком, кооперативные переходы Б. совершаются в конечном, хотя и сравнительно узком, интервале изменений внешних условий. В этом интервале одномерные, линейные молекулы (нуклеиновые кислоты, полипептиды), претерпевающие переход спираль — клубок, разбиваются на чередующиеся спиральные и клубкообразные участки (рис. 3).
Переход спираль — клубок в ДНК наблюдается при повышении температуры, добавлении в раствор кислоты или щёлочи, а также под влиянием других денатурирующих агентов. Этот переход в гомополинуклеотидах происходит при нагревании в интервале десятых долей °С, в фаговых и бактериальных ДНК — в интервале 3—5°С (рис. 3), в ДНК высших организмов — в интервале 10—15 °С. Чем выше гетерогенность ДНК, тем шире интервал перехода и меньше способность молекул ДНК к ренатурации. Переход спираль — клубок в различных видах РНК носит менее кооперативный характер (рис. 4) и происходит в более широком интервале температурных или других денатурирующих воздействий.
Б. — полимерные электролиты, их пространственная конформация и кооперативные переходы зависят как от степени ионизации молекулы, так и от концентрации ионов в среде, что влияет на электростатические взаимодействия как между отдельными частями молекулы, так и между Б. и растворителем.
Строение и биологические функции Б. Строение Б. — результат длительной эволюции на молекулярном уровне, вследствие чего эти молекулы идеально приспособлены к выполнению своих биологических задач. Между первичной структурой, конформацией Б. и конформационными переходами, с одной стороны, и их биологическими функциями — с другой, существуют тесные связи, исследование которых — одна из главных задач молекулярной биологии (См. Молекулярная биология). Установление таких связей в ДНК позволило понять основные механизмы репликации (См. Репликация), транскрипции (См. Транскрипция) и трансляции (См. Трансляция), а также Мутагенеза и некоторых других важнейших биологических процессов. Линейная структура молекулы ДНК обеспечивает запись генетической информации, её удвоение при матричном синтезе ДНК и получение (также путём матричного синтеза) многих копий с одного и того же гена, т. е. молекул и-РНК. Сильные ковалентные связи между нуклеотидами обеспечивают сохранность генетической информации при всех этих процессах. В то же время относительно слабые связи между нитями ДНК и возможность вращения вокруг простых химических связей обеспечивают гибкость и лабильность пространственной структуры, необходимые для разделения нитей при репликации и транскрипции, а также подвижность молекулы и-РНК, служащей матрицей при биосинтезе белка (трансляция). Исследование пространственной структуры и конформационных изменений белков-ферментов на разных стадиях ферментативной реакции при взаимодействии с субстратами и коферментами даёт возможность установить механизмы биокатализа и понять природу огромного ускорения химических реакций, осуществляемого ферментами.
Методы исследования Б. При исследовании строения и конформационных превращений Б. широко используются как очищенные природные Б., так и их синтетические модели, которые проще по строению и легче поддаются исследованию. Так, при изучении белков моделями служат гомогенные или гетерогенные полипептиды (с заданным или случайным чередованием аминокислотных остатков). Моделями ДНК и РНК являются соответствующие синтетические гомогенные или гетерогенные полинуклеотиды. К методам исследования Б. и их моделей относятся рентгеноструктурный анализ, электронная микроскопия, изучение спектров поглощения, оптической активности, люминесценции, методы светорассеяния и динамического двойного лучепреломления, седиментационный метод, вискозиметрия, физико-химические методы разделения и очистки и ряд др. Все методы, разработанные для изучения синтетических полимеров, применимы и к Б. При трактовке свойств Б. и их моделей, закономерностей их конформационных превращений используются также методы теоретической физики (статистической физики, термодинамики, квантовой механики и др.).
Лит.: Бреслер С. Е., Введение в молекулярную биологию, М.—Л., 1966; Волькенштейн М. В., Молекулы и жизнь, М., 1965; Уотсон Дж., Молекулярная биология гена, пер. с англ., М., 1967; физические методы исследования белков и нуклеиновых кислот, М., 1967.
Рис. 1. Образование четвертичной структуры глобулярных белков. Заштрихованы редко — полярные (гидрофильные) части белковых глобул, густо — неполярные (гидрофобные) области.
Рис. 2. Схема денатурации и ренатурации глобулярного белка (на примере фермента рибонуклеазы).
Рис. 3. Схема перехода спираль — клубок для ДНК: 1 — нативное состояние (вместо двойной спирали для простоты изображена «верёвочная лестница»); 2 — состояние ДНК в области перехода; 3 — денатурированное состояние (однонитевые клубки).
Биополимеры
Биополиме́ры — класс полимеров, встречающихся в природе в естественном виде, входящие в состав живых организмов: белки, нуклеиновые кислоты, полисахариды, лигнин. Биополимеры состоят из одинаковых (или схожих) звеньев — мономеров. Мономеры белков — аминокислоты, нуклеиновых кислот — нуклеотиды, в полисахаридах — моносахариды.
Выделяют два типа биополимеров — регулярные (некоторые полисахариды) и нерегулярные (белки, нуклеиновые кислоты, некоторые полисахариды).
Содержание
Белки
Белки имеют несколько уровней организации — первичная, вторичная, третичная, и иногда четвертичная. Первичная структура определяется последовательностью мономеров, вторичная задаётся внутри- и межмолекулярными взаимодействиями между мономерами, обычно при помощи водородных связей. Третичная структура зависит от взаимодействия вторичных структур, четвертичная, как правило, образуется при объединении нескольких молекул с третичной структурой.
Вторичная структура белков образуется при взаимодействии аминокислот с помощью водородных связей и гидрофобных взаимодействий. Основными типами вторичной структуры являются
Для предсказания вторичной структуры используются компьютерные программы.
Третичная структура или «фолд» образуется при взаимодействии вторичных структур и стабилируется нековалентными, ионными, водородными связями и гидрофобными взаимодействиями. Белки, выполняющие сходные функции обычно имеют сходную третичную структуру. Примером фолда является β-баррел (бочка), когда β-листы располагаются по окружности. Третичная структура белков определяется с помощью рентгеноструктурного анализа.
Важный класс полимерных белков составляют Фибриллярные белки, самый известный из которых коллаген.
В животном мире в качестве опорного, структурообразующего полимера обычно выступают белки. Эти полимеры построены из 20 α-аминокислот. Остатки аминокислот связаны в макромолекулы белка пептидными связями, возникающими в результате реакции карбоксильных и аминогрупп.
Значение белков в живой природе трудно переоценить. Это строительный материал живых организмов, биокатализаторы — ферменты, обеспечивающие протекание реакций в клетках, и энзимы, стимулирующие определённые биохимические реакции, то есть обеспечивающие избирательность биокатализа. Наши мышцы, волосы, кожа состоят из волокнистых белков. Белок крови, входящий в состав гемоглобина, способствует усвоению кислорода воздуха, другой белок — инсулин — ответственен за расщепление сахара в организме и, следовательно, за его обеспечение энергией. Молекулярная масса белков колеблется в широких пределах. Так, инсулин — первый из белков, строение которого удалось установить Ф. Сэнгеру в 1953 г., содержит около 60 аминокислотных звеньев, а его молекулярная масса составляет лишь 12 000. К настоящему времени идентифицировано несколько тысяч молекул белков, молекулярная масса некоторых из них достигает 10 6 и более.
Нуклеиновые кислоты
В соответствии с природой углевода, входящего в их состав, нуклеиновые кислоты называются рибонуклеиновой и дезоксирибонуклеиновой кислотами. Общеупотребительными сокращениями являются РНК и ДНК. Нуклеиновые кислоты играют наиболее ответственную роль в процессах жизнедеятельности. С их помощью решаются две важнейшие задачи: хранения и передачи наследственной информации и матричный синтез макромолекул ДНК, РНК и белка.
Полисахариды
Полисахариды, синтезируемые живыми организмами, состоят из большого количества моносахаридов, соединённых гликозидными связями. Зачастую полисахариды нерастворимы в воде. Обычно это очень большие, разветвлённые молекулы. Примерами полисахаридов, которые синтезируют живые организмы, являются запасные вещества крахмал и гликоген, а также структурные полисахариды — целлюлоза и хитин. Так как биологические полисахариды состоят из молекул разной длины, понятия вторичной и третичной структуры к полисахаридам не применяются.
Полисахариды образуются из низкомолекулярных соединений, называемых сахарами или углеводами. Циклические молекулы моносахаридов могут связываться между собой с образованием так называемых гликозидных связей путём конденсации гидроксильных групп.
Наиболее распространены полисахариды, повторяющиеся звенья которых являются остатками α-D-глюкопиранозы или её производных. Наиболее известна и широко применяема целлюлоза. В этом полисахариде кислородный мостик связывает 1-й и 4-й атомы углерода в соседних звеньях, такая связь называется α-1,4-гликозидной.
Химический состав, аналогичный целлюлозе, имеют крахмал, состоящий из амилозы и амилопектина, гликоген и декстран. Отличие первых от целлюлозы состоит в разветвлённости макромолекул, причём амилопектин и гликоген могут быть отнесены к сверхразветвлённым природным полимерам, то есть дендримерам нерегулярного строения. Точкой ветвления обычно является шестой атом углерода α-D-глюкопиранозного кольца, который связан гликозидной связью с боковой цепью. Отличие декстрана от целлюлозы состоит в природе гликозидных связей — наряду с α-1,4-, декстран содержит также α-1,3- и α-1,6-гликозидные связи, причем последние являются доминирующими.
Целлюлоза содержится в коре и древесине деревьев, стеблях растений: хлопок содержит более 90 % целлюлозы, деревья хвойных пород — свыше 60 %, лиственных — около 40 %. Прочность волокон целлюлозы обусловлена тем, что они образованы монокристаллами, в которых макромолекулы упакованы параллельно одна другой. Целлюлоза составляет структурную основу представителей не только растительного мира, но и некоторых бактерий.
В животном мире в качестве опорных, структурообразующих полимеров полисахариды «используются» лишь насекомыми и членистоногими. Наиболее часто для этих целей применяется хитин, который служит для построения так называемого внешнего скелета у крабов, раков, креветок. Из хитина деацетилированием получается хитозан, который, в отличие от нерастворимого хитина, растворим в водных растворах муравьиной, уксусной и соляной кислот. В связи с этим, а также благодаря комплексу ценных свойств, сочетающихся с биосовместимостью, хитозан имеет большие перспективы широкого практического применения в ближайшем будущем.
Крахмал относится к числу полисахаридов, выполняющих роль резервного пищевого вещества в растениях. Клубни, плоды, семена содержат до 70 % крахмала. Запасаемым полисахаридом животных является гликоген, который содержится преимущественно в печени и мышцах.
Из пентоз значение имеют полимеры арабинозы и ксилозы, которые образуют полисахариды, называемые арабинами и ксиланами. Они, наряду с целлюлозой, определяют типичные свойства древесины.