Что такое бинарные оксиды
Оксиды: классификация, получение и химические свойства
В зависимости от второго элемента оксиды проявляют разные химические свойства. В школьном курсе оксиды традиционно делят на солеобразующие и несолеобразующие. Некоторые оксиды относят к солеобразным (двойным).
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, обладающие характерными основными свойствами. К ним относят оксиды, образованные атомами металлов со степень окисления +1 и +2.
Кислотные оксиды — это оксиды, характеризующиеся кислотными свойствами. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и кислотными свойствами. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Классификация оксидов
Получение оксидов
Общие способы получения оксидов:
1. Взаимодействие простых веществ с кислородом :
1.1. Окисление металлов: большинство металлов окисляются кислородом до оксидов с устойчивыми степенями окисления.
Не взаимодействуют с кислородом золото, платина, палладий.
Натрий при окислении кислородом воздуха образует преимущественно пероксид Na2O2,
Калий, цезий, рубидий образуют преимущественно пероксиды состава MeO2:
Примечания : металлы с переменной степенью окисления окисляются кислородом воздуха, как правило, до промежуточной степени окисления (+3):
Железо также горит с образованием железной окалины — оксида железа (II, III):
1.2. Окисление простых веществ-неметаллов.
Как правило, при окислении неметаллов образуется оксид неметалла с высшей степенью окисления, если кислород в избытке, или оксид неметалла с промежуточной степенью окисления, если кислород в недостатке.
Оксид серы (VI) можно получить только окислением оксида серы (IV) в жестких условиях в присутствии катализатора:
2SO2 + O2 = 2SO3
Азот окисляется кислородом только при очень высокой температуре (около 2000 о С), либо под действием электрического разряда, и только до оксида азота (II):
Не окисляется кислородом фтор F2 (сам фтор окисляет кислород). Не взаимодействуют с кислородом прочие галогены (хлор Cl2, бром и др.), инертные газы (гелий He, неон, аргон, криптон).
2. Окисление сложных веществ (бинарных соединений): сульфидов, гидридов, фосфидов и т.д.
При окислении кислородом сложных веществ, состоящих, как правило, из двух элементов, образуется смесь оксидов этих элементов в устойчивых степенях окисления.
Сероводород горит с образованием оксида серы (IV) при избытке кислорода и с образованием серы при недостатке кислорода:
А вот аммиак горит с образованием простого вещества N2, т.к. азот реагирует с кислородом только в жестких условиях:
А вот в присутствии катализатора аммиак окисляется кислородом до оксида азота (II):
3. Разложение гидроксидов. Оксиды можно получить также из гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы, и самопроизвольную распадаются на оксид и воду; для разложения некоторых других (как правило, нерастворимых в воде) гидроксидов необходимо их нагревать (прокаливать).
гидроксид → оксид + вода
Самопроизвольно разлагаются в водном растворе угольная кислота, сернистая кислота, гидроксид аммония, гидроксиды серебра (I), меди (I):
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
При нагревании разлагаются на оксиды большинство нерастворимых гидроксидов — кремниевая кислота, гидроксиды тяжелых металлов — гидроксид железа (III) и др.:
Соли, образованные сильными кислотами-окислителями (нитраты, сульфаты, перхлораты и др.), при нагревании, как правило, разлагаются с с изменением степени окисления:
Более подробно про разложение нитратов можно прочитать в статье Окислительно-восстановительные реакции.
Химические свойства оксидов
Значительная часть химических свойств оксидов описывается схемой взаимосвязи основных классов неорганических веществ.
Химические свойства основных оксидов
Подробно про химические свойства оксидов можно прочитать в соответствующих статьях:
Бинарные соединения
Бина́рные соедине́ния — химические вещества, образованные, как правило, двумя химическими элементами. Термин «бинарные соединения» обычно не применяется в отношении основных и кислотных оксидов. При этом несолеобразующие оксиды включают в бинарные соединения. Многоэлементные вещества, в формульной единице которых одна из составляющих содержит не связанные между собой атомы нескольких элементов, а также одноэлементные или многоэлементные группы атомов (кроме гидроксидов и солей), рассматривают как бинарные соединения.
Бинарные соединения, несмотря на кажущуюся простоту их химического состава, представляют собой следующий после простых веществ принципиально важный объект изучения природы вещества. С химической точки зрения, этот класс веществ обладает и качественно иными характеристиками, с которыми не приходится сталкиваться при изучении простых веществ. Во-первых, помимо внешних факторов, влияющих на состояние и свойства вещества (температура и давление), здесь появляется и внутренний фактор — состав, и связанная с ним проблема постоянства и переменности состава, имеющая фундаментальное значение в химии. Во-вторых, при описании бинарных соединений впервые формируются такие базисные понятия, как валентность, степень окисления, поляризация химической связи. Здесь, в отличие от простых веществ, появляются гетерополярная составляющая химической связи и все эффекты, связанные с разностью электроотрицательностей компонентов.
Исключительно важную роль играют бинарные соединения с классификационной точки зрения. Многие из них относятся и к так называемым характеристическим соединениям, отражающим типичные степени окисления и их сравнительную стабильность. К таким соединениям относятся прежде всего оксиды, летучие водородные соединения, а также галогениды.
Содержание
Номенклатура
Бинарные соединения — это собирательная группа веществ, которые имеют различное химическое строение. Поэтому их номенклатура может варьироваться в зависимости от генетической принадлежности.
Названия простых бинарных веществ, как правило, образуются добавлением к названию более электроотрицательного элемента суффикса -ид. При необходимости к названиям элементов добавляют кратные приставки или указывают в скобках степень окисления электроположительного элемента без пробела:
В сложных бинарных соединениях суффикс -ид добавляется к названиям элементов, находящихся в низших степенях окисления:
Многие широко известные бинарные соединения носят тривиальные названия, среди них уже приведенный выше фосген, вода H2O аммиак NH3, веселящий газ N2O и другие.
Свойства
Группа бинарных соединений включает в себя очень большое число веществ, и, естественно, все эти вещества различаются по физическим свойствам. Среди бинарных соединений есть представляющие собой при нормальных условиях газы (например, аммиак, фосфин), жидкости (например, тетрахлорид титана TiCl4, дисульфид углерода CS2) и твердые вещества (например, нитрид бора BN, карбид кремния SiC)
Химическая связь в бинарных соединениях — ковалентная полярная (в соединениях неметаллов и некоторых амфотерных элементов) или ионная (в солях бескислородных кислот).
Многие бинарные соединения гидролизуются водой, например фосфин или хлорид алюминия.
Получение
Часто бинарные соединения можно получить прямым взаимодействием простых веществ между собой:
Другие бинарные вещества могут получаться более сложным путем — через реакции обмена или окислительно-восстановительные реакции:
Применение
В силу того, что к данной группе веществ можно отнести очень большое их количество, можно сказать, что бинарные соединения применяются практически во всех областях деятельности человека, от приготовления пищи до использования в качестве сырья для крупнотоннажных производств. Ниже приведены примеры использования некоторых веществ, относящихся к бинарным соединениям.
Аммиак
В химической промышленности аммиак используется в качестве прекурсора для получения азотной кислоты и для производства химических удобрений. Кроме того, аммиак используется в большом количестве разнообразных химических синтезов, в том числе в тонком органическом синтезе. В жидком аммиаке химически растворяются многие вещества, например, калий, натрий, сера. Аммиак применялся в качестве хладагента в первых холодильниках, и до недавнего времени превалировал в промышленных холодильных установках.
Гексафторид урана
Летучий гексафторид урана UF6 применяется для разделения изотопов урана в процессе его обогащения, а также как фторирующий агент.
Карбид вольфрама
Оксид диазота
«Веселящий газ» N2O в смесях с кислородом применяется в медицине как агент для ингаляционного общего наркоза.
Хлороводород
Водный раствор хлороводорода (соляная кислота) широко используется для получения хлоридов, для травления металлов, очистки поверхности сосудов, скважин от карбонатов, обработки руд, при производстве каучуков, глутамата натрия, соды, хлора и других продуктов. Также применяется в органическом синтезе.
Литература
Андреева Л. Л., Лидин Р. А., Молочко В. А. Химические свойства неорганических веществ. Учебное пособие для вузов. — М.: Химия, 1996
Полезное
Смотреть что такое «Бинарные соединения» в других словарях:
Нестехиометрические соединения — Бертоллиды (термин в память К.Л. Бертолле) соединения переменного состава, не подчиняющиеся законам постоянных и кратных отношений. Это нестехиометрические бинарные соединения переменного состава, зависящего от способа получения. Многочисленные… … Википедия
НИКЕЛЬОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ — содержат связь NiЧС. Связь Ni с орг. лигандом может осуществляться по s и p типу (соотв. s и p комплексы). s К о м п л е к с ы. Соед. Ni с s связью NiЧС относятся в осн. к типам [Ni(R2)L2] и [NiX(R)L2] (R = Alk или Аr, L = PR 3, амины и др., Х… … Химическая энциклопедия
МЕТАЛЛИЧЕСКИЕ СОЕДИНЕНИЯ — (металлиды), обладают металлич. св вами, в частности электрич. проводимостью, что обусловлено металлич. характером хим. связи. К М. с. относятся соед. металлов друг с другом интер металлиды и мн. соед. металлов (в осн. переходных) с неметаллами.… … Химическая энциклопедия
полупроводниковые материалы — полупроводники, применяемые для изготовления электронных приборов и устройств. Используют главным образом кристаллические полупроводниковые материалы (например, легированные монокристаллы кремния или германия, химические соединения некоторых… … Энциклопедический словарь
Химическая номенклатура — страдает беспринципностью и синонимизмом, благодаря чему она трудна для изучения (ср. отзыв о ней Дюма Орто). Древние называли различные вещества частью по их происхождению, частью по месторождению, частью же употребляли для них случайные… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Плутоний — 94 Нептуний ← Плутоний → Америций Sm ↑ Pu … Википедия
Неорганическое вещество — или неорганическое соединение это химическое вещество, химическое соединение, которое не является органическим, то есть оно не содержит углерода (кроме карбидов, цианидов, карбонатов, оксидов углерода и некоторых других соединений, которые… … Википедия
МОЛЕКУЛЯРНЫЕ КРИСТАЛЛЫ — кристаллы, образованные из молекул, связанных друг с другом слабыми ван дер ваальсовыми силами или водородной связью (см. МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ, МЕЖАТОМНОЕ ВЗАИМОДЕЙСТВИЕ). Внутри молекул между атомами действует более прочная, обычно… … Физическая энциклопедия
Фосфиды — Фосфиды бинарные соединения фосфора с другими менее электроотрицательными химическими элементами, в которых фосфор проявляет отрицательную степень окисления. Получение Большинство фосфидов представляют собой соединения фосфора с типичными… … Википедия
Оксид цезия — Общие … Википедия
Бинарные соединения (оксиды, галогениды, сульфиды)
Бинарными соединениями называют соединения, образованные двумя элементами. Наиболее распространёнными и важными являются соединения различных элементов с кислородом (оксиды), элементами 7-й группы главной подгруппы, называемых общим термином галогены – фтором, хлором, бромом и иодом (галогениды) и серой (сульфиды).
2Ca + O2 =2CaO оксид кальция;
2Mg + O2 =2MgO оксид магния;
Si + O2 = SiO2 оксид кремния;
Реакции элементов с галогенами сопровождаются образованием галогенидов:
H2 + Cl2 = 2HCl хлорид водорода (хлористый водород);
2Na + Cl2 = 2NaCl хлорид натрия (поваренная соль);
Сa + F2 = CaF2 фторид кальция;
2Al + 3I2 = 2AlI3 иодид алюминия.
Водные растворы соединений галогенов с водородом являются кислотами, например HF – плавиковая кислота, HCl – соляная или хлористоводородная кислота.
Многие элементы могут вступать в реакции с серой, образуя сульфиды:
2Na + S = Na2S сульфид натрия;
Mg + S =MgS сульфид магния.
Водный раствор соединения серы с водородом (H2S) проявляет кислотные свойства и носит название сероводородной кислоты.
Химические свойства оксидов.Оксиды металлов 1-й и 2-й групп главных подгрупп ПСЭМ могут взаимодействовать с водой, образуя гидроксидыили основания:
Na2O + H2 O = 2NaOH гидроксид натрия (едкий натр);
СаO + H2 O = Ca(OH)2 гидроксид кальция (гашёная известь).
Оксиды, способные образовывать прямо или косвенно основания, называют основными оксидами.
Оксиды многих неметаллов при взаимодействии с водой образуют кислоты:
Оксиды, способные образовывать прямо или косвенно кислоты, называют кислотными оксидами.
Основные оксиды способны взаимодействовать с кислотными оксидами с образованием солей:
СаO + СO2 = СаСO3, карбонат кальция, соль угольной кислоты;
MgO + SO3 = MgSO4, сульфат магния, соль серной кислоты.
Ряд оксидов, называемых амфотерными,способен реагировать и с кислотными и основными оксидами. К ним относятся, например, оксиды бериллия, алюминия, цинка.
ZnO + СаO = СaZnO2, цинкат кальция;
Гидроксиды (кислоты, основания,
Амфотерные гидроксиды)
Основания и содержащие кислород кислоты имеют в своём составе гидроксидную группу (ОН), и называются гидроксидами. Например:
Различия в химических свойствах гидроксидов определяются различиями свойств атомов, с которыми связаны гидроксидные группировки ОН. Гидроксиды, образованные атомами с валентностью, равной 1,почти всегда являются основаниями. Большинство гидроксидов, образованных двухвалентными атомами, также относятся к основаниям. Гидроксиды, образованные атомами с валентностью от 4 до 8, относятся к кислотам. Если же валентность атомов равна 3, то их гидроксиды обычно являются амфотерными. Амфотерными являются также некоторые из гидроксидов двухвалентных и четырехвалентных атомов.
Для кислот характерны следующие основные химические свойства:
1) взаимодействие с активными металлами с образованием солей и выделением водорода:
2) взаимодействие с основаниями и амфотерными гидроксидами (реакция нейтрализации), в результате чего образуются соли и вода:
3) взаимодействие с основными и амфотерными оксидами с образованием солей и воды:
Наиболее типичными реакциями оснований являются:
1) взаимодействие с кислотами и амфотерными гидроксидами с образованием солей и воды (реакция нейтрализации):
2) взаимодействие с кислотными и амфотерными оксидами с образованием солей и воды:
Амфотерные гидроксиды ведут себя в реакциях с кислотами как основания, а в реакциях с основаниями как кислоты.
В таблице 3.1. приведены формулы и названия важнейших кислот и их солей и ряда оснований.
Соли
Соединения, содержащие в своём составе атомы металлов и кислотные остатки, называются солями.
Соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металла. При полном замещении всех атомов водорода в молекуле кислоты образуются средние соли, например Na2SO4 – сульфат натрия. При частичном замещении атомов водорода образуются кислые соли, например NaHSO4 – гидросульфат натрия (устаревшее название – бисульфат натрия).
Соли можно также рассматривать как продукты замещения гидроксидных групп в молекуле основания на кислотные остатки. При полном замещении всех гидроксидных групп образуются средние соли, например СаCl2. При частичном замещении образуются основные соли, например Ca(OH)Cl – гидроксохлорид кальция. Очевидно, что
Таблица 3.1. Формулы и названия некоторых оснований, кислот и их солей.
| Формула | Химическое название | Синоним (тривиальное название) | Химическое название солей |
| H2SO4 | Серная кислота | Сульфаты | |
| HNO3 | Азотная кислота | Нитраты | |
| HCl | Хлористоводородная кислота | Соляная кислота | Хлориды |
| H2CO3 | Угольная кислота | Карбонаты | |
| NaOH | Гидроксид натрия | Едкий натр, каустическая сода | |
| KOH | Гидроксид калия | Едкое кали | |
| Ca(OH)2 | Гидроксид кальция | Гашеная известь | |
| NH4OH | Гидроксид аммония | Водный ам-миак, наша-тырный спирт |
основные соли не могут быть образованы гидроксидами одновалентных металлов.
Приведем некоторые химические свойства солей:
1) взаимодействие с растворимыми в воде основаниями (NaOH, КOH, Са(OH)2); реакции протекают в том случае, если образующийся гидроксид плохо растворим в воде.:
Стрелка означает, что гидроксид цинка выпадает в осадок.
2) взаимодействие с кислотами; реакция протекает, если продукт реакции является летучим:
Угольная кислота неустойчива, легко разлагается на воду и летучий углекислый газ. Иначе реакция может быть записана так:
Стрелка означает, что углекислый газ улетучивается.
3) Соли взаимодействуют друг с другом, если один из продуктов реакции плохо растворим в воде:
Презентация была опубликована 7 лет назад пользователемАнгелина Ширманова
Похожие презентации
Презентация на тему: » Оксиды – бинарные соединения Цель: научиться составлять формулы бинарных соединений; познакомиться с важнейшими оксидами и водородными соединениями.» — Транскрипт:
1 Оксиды – бинарные соединения Цель: научиться составлять формулы бинарных соединений; познакомиться с важнейшими оксидами и водородными соединениями.
2 Бинарные соединения Состоят из двух элементов СаО СО 2 Н 2 О HCl NH 3
3 Бинарные соединения На первом месте металл, название по второму элементу: NaCl – хлорид натрия BaS – сульфид бария Na 2 S – сульфид натрия KI – иодид калия Na 2 O – оксид натрия MgO – оксид магния Li 2 O – оксид лития Al 2 O 3 – оксид алюминия
5 Формула оксидов: Э х О у Оксиды – сложные вещества, состоящие из атомов двух химических элементов, один из которых кислород.
7 Составим формулы оксидов: 1.Запишите элементы, кислород на втором месте. 2. Проставьте степени окисления. 3. Допишите индексы в формуле и дайте название соединению
11 Al 2 O 3 Оксид алюминия
12 Составьте формулы веществ и дайте им названия: CaO BaCl AlS BO SiO NO CaO – оксид кальция BaCl 2 – хлорид бария Al 2 S 3 – сульфид алюминия B 2 O 3 – оксид бора SiO 2 – оксид кремния N 2 O 5 – оксид азота
13 Название оксидов Оксид + название химического элемента Оксид магния – МgО Оксид водорода – Н 2 О При переменной валентности указать в скобках римскую цифру Оксид железа (ІІІ) – Fe 2 О 3 Оксид фосфора (V) – Р 2 О 5
15 Применение оксидов Из руд, состоящих из Fe 2 О 3, получают чугун и сталь; СаО – основная часть негашеной извести; SіО 2 – в производстве строительных материалов; ZnО и Сr 2 О 3 – для производства красок.
16 Оксиды бывают: 1.Кислотные (неметаллов) 2.Основные (металлов) Кислотные кислоты Основные основания
17 Выделение СО и СО 2
18 Важнейшие оксиды СО 2 – углекислый газ
19 Важнейшие оксиды СаО – негашёная известь
21 Летучие водородные соединения НCl – хлороводород NH 3 – аммиак
23 Закрепление: Напишите формулы оксидов: Оксид хрома (III) Оксид магния Оксид меди (II) Оксид лития Оксид бора Оксид железа (III)
24 Домашнее задание Параграф 18, уметь рассказать о важнейших оксидах и водородных соединениях. Упр 1,2. упр5,6 с.91 (задачи)
Водородные соединения. Оксиды
Урок 19. Химия 8 класс
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Водородные соединения. Оксиды»
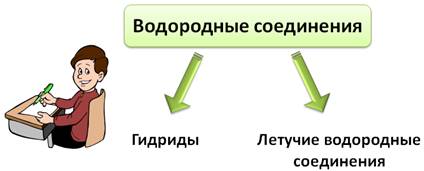
Само название «водородные соединения» говорит о том, что в состав данных соединений входит водород. К таким соединениям относятся гидриды и летучие водородные соединения. Давайте разберемся, в чем их отличие.
Гидриды – это бинарные соединения металлов I и II A групп с водородом. Например: CaH2, NaH, BaH2, LiH. Все эти гидриды твердые, нелетучие, тугоплавкие вещества с ионным типом связи.
Летучие водородные соединения – это бинарные соединения неметаллов с водородом. Эти соединения могут быть как жидкостями (например, Н2О), так и газами (HCl, NH3).
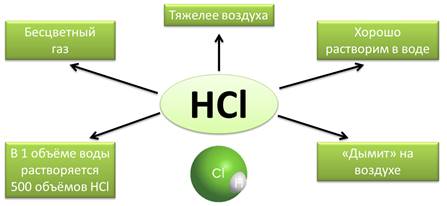
Рассмотрим свойства хлороводорода – HCl. Это бесцветный газ, тяжелее воздуха, хорошо растворим в воде. В 1 объёме воды растворяется 500 объёмов хлороводорода. Хлороводород «дымит» на воздухе, т.е. он поглощает пары воды из воздуха, образуя при этом туманное облако.
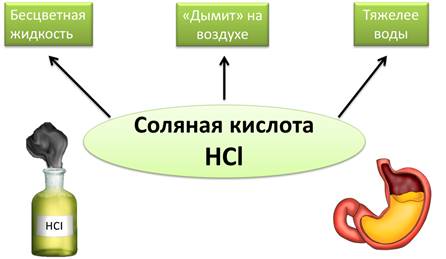
Раствор хлороводорода в воде называют соляной кислотой. Это бесцветная жидкость, «дымит» на воздухе, тяжелее воды. Соляная кислота содержится в желудочном соке человека и некоторых животных.
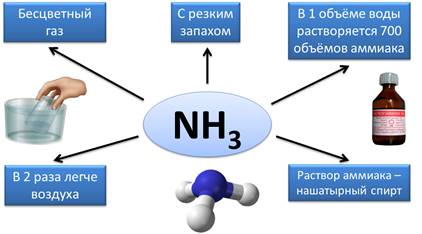
Известным и распространенным водородным соединением является аммиак – NH3. Аммиак является бесцветным газом, имеет резкий запах, в 1 объёме воды растворяется 700 объёмов аммиака, он почти в 2 раза легче воздуха. Раствор аммиака в воде называют нашатырным спиртом, который широко используют в медицине.
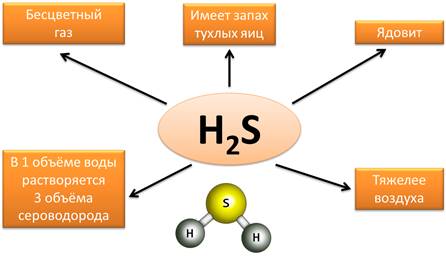
Сероводород – H2S – тоже известное летучее водородное соединение. Он является бесцветным газом, имеет запах тухлых яиц, ядовит, в 1 объеме воды растворяется 3 объёма сероводорода, он тяжелее воздуха.
В названии оксидов сначала указывают слово оксид в именительном падеже (от лат. названия кислорода – «оксигениум»), а затем название элемента в родительном падеже.
Например: CaO – оксид кальция, K2O – оксид калия, Al2O3 – оксид алюминия. А если элемент имеет несколько степеней окисления или переменную валентность, то после названия оксида в скобках римскими цифрами указывают численное значение степени окисления. Например: Fe2O3 – оксид железа (III) (читается: «оксид железа три»), CuO – оксид меди (II) (читается: «оксид меди два»), CrO3 – оксид хрома (VI) (читается: «оксид хрома шесть»).
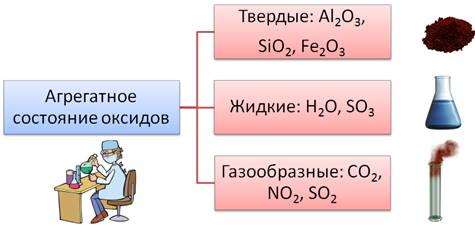
По агрегатному состоянию оксиды делят на твёрдые: к ним относятся такие оксиды, как Al2O3, SiO2, Fe2O3 и др., жидкие оксиды – это H2O, SO3, газообразными являются такие оксиды, как СО2, NO2, SO2 и др.
Познакомимся с вами с наиболее важными оксидами.
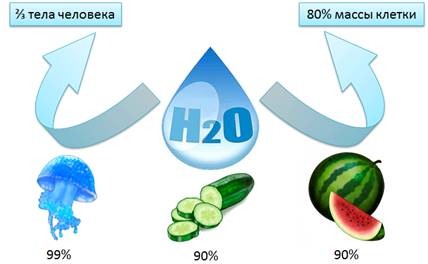
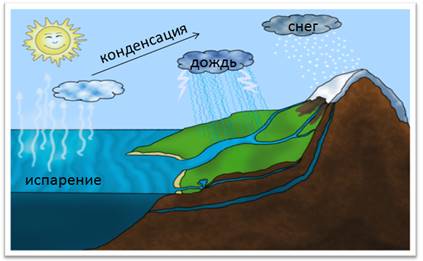
Вода – Н2О – самое распространенное и самое необходимое вещество на планете. Почти ¾ поверхности земного шара занято водой. Однако, это вода морей и океанов, которая является солёной. Она непригодна для питья, для сельского хозяйства, для промышленности. Кроме того, тело человека на 2/3 состоит из воды. Вода составляет до 80% массы клетки и выполняет важные функции: защитную, транспортную и др. У некоторых медуз вода занимает почти 99% от массы тела. Содержание воды в огурцах и арбузах превышает 90%. Большинство реакций и процессов в различных отраслях промышленности тоже протекают в растворах. Однако запасы пресной воды малы, всего 3% от общего объёма, поэтому нужно беречь и экономить воду. Без воды невозможно представить жизнь человека, который потребляет ее для бытовых нужд.
В природе постоянно происходит круговорот воды. Под влиянием солнечного тепла часть воды испаряется в атмосферу. При охлаждении воздуха образуются водяные капельки, из которых состоят облака. Эти мелкие капельки сливаются в более крупные и выпадают на землю в виде осадков: снега, дождя, града.
Круговорот воды в природе
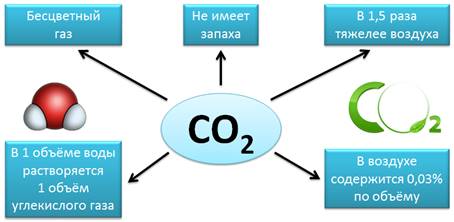
Еще одним известным оксидом является диоксид углерода, углекислый газ, или оксид углерода (IV) – CO2. Это бесцветный газ, не имеет запаха, в 1,5 раза тяжелее воздуха. В 1 объёме воды растворяется 1 объем углекислого газа. В воздухе содержится 0,03% (по объему) диоксида углерода.
Большое количество углекислого газа вызывает удушье. Например, в «Собачьей пещере» вблизи Неаполя, известной еще из древности, заходившие сюда собаки постоянно погибали из-за скопившегося газа, который стелется по дну пещеры слоем до полуметра. Углекислый газ образуется при дыхании, сгорании топлива, тлении и гниении различных организмов. Большое содержание углекислого газа в минеральной воде «Нарзан», находящейся в Кисловодске. Углекислый газ используют для получения газированных вод, а твердый диоксид углерода, или «сухой лед» используют для хранения продуктов питания, в частности мороженого. Т.к. углекислый газ не поддерживает горение, его используют для тушения пожаров. В медицине углекислый газ используют для углекислотных ванн.
Негашеная известь, или СаО, является белым, тугоплавким веществом, которое энергично реагирует с водой, при этом образуется гашеная известь. Негашеная известь применяется для получения вяжущих строительных материалов.
Основная часть литосферы – это оксид кремния (IV) – SiO2. Он входит в состав минералов и горных пород. Этот оксид образует кварц, кварцевый песок, кремнезем, горный хрусталь и др. соединения.
Еще одно соединение, которое является основой литосферы – это оксид алюминия – Al2O3. Он также входит в состав минералов и горных пород. Этот оксид образует корунд, рубин, сапфир, каолин и др. соединения.