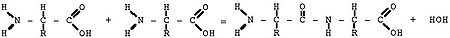Что такое белки в биологии 9 класс определение
Урок Бесплатно Органические вещества клетки. Белки. Жиры. Углеводы
Ведение
В клетках нашего организма помимо неорганических веществ содержатся органические вещества, которые необходимы клетке для построения ее структур и обеспечения нормальной жизнедеятельности не только отдельно взятой клетки, но и всего организма в целом.
Органические вещества, которые входят в состав живого организма, многообразны, и многие из них имеют очень сложное молекулярное строение.
Каждое сложное органическое вещество построено из повторяющихся единиц- мономеров.
Если мономеров в веществе большое количество, то такое вещество называют полимер ( от греч. «поли»- много, «мерос»- часть).
Если полимеры встречаются в природе в естественном виде, то есть входят в состав живых организмов, их называют биополимерами.
Количество мономеров в молекуле полимера может исчисляться от нескольких штук до десятков миллионов.
К примеру, молекула ДНК бактерий построена более чем из 3 млн мономеров (нуклеотидов).
Основные и наиболее важные группы органических веществ клетки:
Сегодня мы рассмотрим эти группы органических веществ, узнаем их строение и значение для организма.
Белки
Белки- это биополимеры, мономерами которых являются аминокислоты.
Аминокислоты содержат в своём составе карбоксильную (-СООН) и аминогруппу (-NH2)
Молекулы белка могут содержать сотни и даже тысячи аминокислотных остатков.
А если молекула содержит до 100 аминокислотных остатков, то принято называть эту молекулу пептидом.
Также в состав белков входят углерод, водород, кислород и азот, сера.
Белок характеризуется определенной последовательностью аминокислот. Благодаря этой последовательности формируется химическая формула белка, то есть его структура.
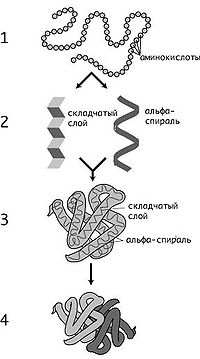
Кроме определенной последовательности аминокислотных остатков, очень важна и трехмерная структура белка, которая формируется в результате сворачивания цепочки из аминокислот.
Аминокислотные остатки в белке связаны пептидной связью:
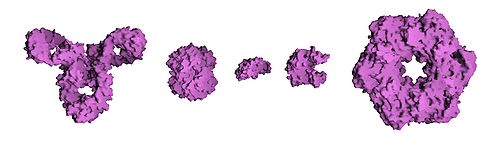
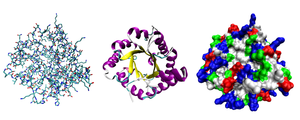
Выделяют четыре структуры белка:
Структуры белка
Строение
Типы химических взаимодействий(связи)
Примеры белков и графическое изображение
Первичная структура
(линейная)
Последовательность аминокислотных остатков в полипептидной цепи
Альбумин, яичный белок, состоит из аминокислот. Мономеры связаны пептидными связями, молекула образует первичную, вторичную и третичную структуры
Скручивание в спираль первичной структуры белка, стабилизировано водородными связями и гидрофобными взаимодействиями
Водородные между пептидными группами (C=O…H–N) и гидрофобные связи
Альбумин- вареный яичный белок, кератин (в сухожилиях человека), коллаген (в волосах, ногтях)
Упаковка вторичной спирали в клубок- глобулу (в виде шарика), также встречается фибриллярная структура (в виде волокон)
Ковалентные связи, ионные (электростатические) взаимодействия (между противоположно заряженными аминокислотными остатками);
Объединение нескольких глобул в сложный комплекс
Фибриллярные и глобулярные белки:
Фибриллярные белки
Глобулярные белки
Представляет собой длинные, узкие закрученные нити
Имеет округлую, сферическую форму
Отчасти растворимы (образуют коллоидные растворы)
Коллаген (кожа, кости, зубы, сухожилия), кератин (волосы, ногти)
Гемоглобин (в эритроцитах), инсулин (гормон поджелудочной железы), каталаза (обеспечивает распад пероксида водорода в живых клетках)
Структура и функции
Коллаген существует в виде тройной спирали, механически стойкой и прочной.
Много в сухожилиях, связках, соединительной ткани, мышцах, коже и других тканях, испытывающих на себе сильное механическое воздействие, выполняют структурную и сократительную функцию
Выполняют различные функции в клетках.
У меня есть дополнительная информация к этой части урока!
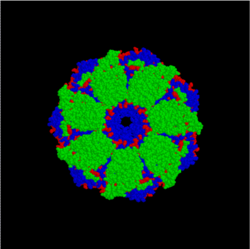
Гемоглобин- белок содержащийся в кровяных клетках, эритроцитах, который переносит кислород и углекислый газ, обладает четвертичной структурой.
В связывании кислорода принимает участие непосредственно ион железа, который содержится в молекуле гемоглобина.
Оксид углерода СО (угарный газ) связывается с железом в сотни раз прочнее кислорода, поэтому угарный газ смертельно опасен для человека, поскольку лишает гемоглобин возможности присоединять кислород
Денатурация и ренатурация белков
Белки могут быть активны в организме и выполнять свою функцию только при определенных физических показателях.
Например, при повышении или понижении температуры, радиации, воздействии кислот естественная структура белка может нарушаться, что, в свою очередь, может привести к гибели всей клетки.
Процесс разрушения характерной для данного белка естественной структуры (вторичной, третичной, четвертичной), носит название денатурация.
Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка.
Как правило, при этом первичная структура белка не разрушается.
Пример денатурации является свертывание яичного белка при его варке.
Денатурация бывает обратимой и необратимой.
При варке яйца происходит необратимая денатурация, так как исходную структуру восстановить уже практически невозможно и происходит разрыв большого количества связей.
Обратимая денатурация происходит если возможно восстановление свойственной белку структуры.
Если белок подвергся обратимой денатурации, то при восстановлении нормальных условий среды он способен полностью восстановить свою структуру и, соответственно, свои свойства и функции.
Процесс восстановления структуры белка после денатурации называется ренатурацией.
Функции белков в организме связаны с пространственной структурой белка и зависят от последовательности аминокислот в белке.
Основные функции белков:
Пройти тест и получить оценку можно после входа или регистрации
Липиды (жиры)
Липиды— сборная группа биологических соединений, полностью или почти полностью нерастворимых в воде, но растворимых в органических растворителях и друг в друге.
Таким образом, липиды — это гидрофобные соединения, то есть их молекулы по своим свойствам «стремятся» избежать контакта с водой.
Липиды широко распространены в природе и являются обязательным компонентом каждой живой клетки и ее мембран.
Липиды в клетке образуются на гладкой эндоплазматической мембране.
Они образуют энергетический резерв организма и участвуют в передаче нервного импульса, в создании водоотталкивающих и термоизоляционных покровов и др.
У меня есть дополнительная информация к этой части урока!
Особое место среди липидов занимают стероиды: полициклический спирт холестерол (чаще называемый холестерин) и его производные.
Холестерин и его эфиры с жирными кислотами входят в состав биологических мембран клеток животных, придавая им определенную «жесткость».
У растений и грибов холестерин не встречается, его место у растений занимает стероид стигмастерол, а у грибов- эргостерол.
У животных из холестерина образуются гормоны
Пройти тест и получить оценку можно после входа или регистрации
Белки
Белки́ (протеи́ны, полипепти́ды [1] ) — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа-аминокислот. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций дают большое разнообразие свойств молекул белков. Кроме того, аминокислоты в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул белков образуют сложные комплексы, например, фотосинтетический комплекс.
Функции белков в клетках живых организмов более разнообразны, чем функции других биополимеров — полисахаридов и ДНК. Так, белки-ферменты катализируют протекание биохимических реакций и играют важную роль в обмене веществ. Некоторые белки выполняют структурную или механическую функцию, образуя цитоскелет, поддерживающий форму клеток. Также белки играют важную роль в сигнальных системах клеток, при иммунном ответе и в клеточном цикле.
Белки — важная часть питания животных и человека (основные источники: мясо, птица, рыба, молоко, орехи, бобовые, зерновые; в меньшей степени: овощи, фрукты, ягоды и грибы), поскольку в их организмах не могут синтезироваться все необходимые аминокислоты и часть из них поступает с белковой пищей. В процессе пищеварения ферменты разрушают потреблённые белки до аминокислот, которые используются при биосинтезе белков организма или подвергаются дальнейшему распаду для получения энергии.
Содержание
История изучения
Сложность выделения чистых белков затрудняла их изучение. Поэтому первые исследования проводились с использованием тех полипептидов, которые могли быть очищены в большом количестве, то есть белков крови, куриных яиц, различных токсинов, а также пищеварительных/метаболических ферментов, выделяемых после забоя скота. В конце 1950-х годов компания Armour Hot Dog Co. смогла очистить килограмм бычьей панкреатической рибонуклеазы А, которая стала экспериментальным объектом для многих учёных.
Идея о том, что вторичная структура белков — результат образования водородных связей между аминокислотами, была высказана Уильямом Астбери в 1933 году, но Лайнус Полинг считается первым учёным, который смог успешно предсказать вторичную структуру белков. Позднее Уолтер Каузман, опираясь на работы Кая Линдерстрём-Ланга, внёс весомый вклад в понимание законов образования третичной структуры белков и роли в этом процессе гидрофобных взаимодействий. В 1949 году Фред Сенгер определил аминокислотную последовательность инсулина, [8] продемонстрировав таким способом, что белки — это линейные полимеры аминокислот, а не их разветвлённые (как у некоторых сахаров) цепи, коллоиды или циклолы. Первые структуры белков, основанные на дифракции рентгеновских лучей на уровне отдельных атомов, были получены в 1960-х годах и с помощью ЯМР в 1980-х годах. В 2006 году Банк данных о белках (Protein Data Bank) содержал около 40 000 структур белков.
В XXI веке исследование белков перешло на качественно новый уровень, когда исследуются не только индивидуальные очищенные белки, но и одновременное изменение количества и посттрансляционных модификаций большого числа белков отдельных клеток, тканей или организмов. Эта область биохимии называется протеомикой. С помощью методов биоинформатики стало возможно не только обработать данные рентгенно-структурного анализа, но и предсказать структуру белка, основываясь на его аминокислотной последовательности. В настоящее время криоэлектронная микроскопия больших белковых комплексов и предсказание малых белков и доменов больших белков с помощью компьютерных программ по точности приближаются к разрешению структур на атомном уровне.
Свойства
Размер белка может измеряться в числе аминокислот или в дальтонах (молекулярная масса), чаще из-за относительно большой величины молекулы в производных единицах — килодальтонах (кДа). Белки дрожжей, в среднем, состоят из 466 аминокислот и имеют молекулярную массу 53 кДа. Самый большой из известных в настоящее время белков — титин — является компонентом саркомеров мускулов; молекулярная масса его различных изоформ варьирует в интервале от 3000 до 3700 кДа, он состоит из 38 138 аминокислот (в человеческой мышце solius [9] ).
Белки являются амфотерными полиэлектролитами (полиамфолитами), при этом группами, способными к ионизации в растворе, являются карбоксильные остатки боковых цепей кислых аминокислот (аспарагиновая и глутаминовая кислоты) и азотсодержащие группы боковых цепей основных аминокислот (в первую очередь ε-аминогруппа лизина и амидиновый остаток CNH(NH2) аргинина, в несколько меньшей степени — имидазольный остаток гистидина). Белки как полиамфолиты характеризуются изоэлектрической точкой (pI) — кислотностью среды pH, при которой молекулы данного белка не несут электрического заряда и, соответственно, не перемещаются в электрическом поле (например, при электрофорезе). Величина pI определяется отношением кислотных и основных аминокислотных остатков в белке: увеличение количества остатков основных аминокислот в данном белке ведёт к увеличению pI; увеличение количества остатков кислых аминокислот приводит к снижению значения pI.
Значение изоэлектрической точки является характерной константой белков. Белки с pI меньше 7 называются кислотными, а белки с pI больше 7 — основными. В целом, pI белка зависит от выполняемой им функции: изоэлектрическая точка большинства белков тканей позвоночных лежит в пределах от 5,5 до 7,0, однако в некоторых случаях значения лежат в экстремальных областях: так, например, для пепсина — протеолитического фермента сильнокислого желудочного сока pI
12. Белки, связывающиеся с нуклеиновыми кислотами за счёт электростатического взаимодействия с фосфатными остатками нуклеиновых кислот, часто являются основными белками. Примером таких белков служат гистоны и протамины.
Белки различаются по степени растворимости в воде, но большинство белков в ней растворяются. К нерастворимым относятся, например, кератин (белок, из которого состоят волосы, шерсть млекопитающих, перья птиц и т. п.) и фиброин, который входит в состав шёлка и паутины. Белки также делятся на гидрофильные и гидрофобные. К гидрофильным относятся большинство белков цитоплазмы, ядра и межклеточного вещества, в том числе нерастворимые кератин и фиброин. К гидрофобным относятся большинство белков, входящих в состав биологических мембран интегральных мембранных белков, которые взаимодействуют с гидрофобными липидами мембраны [11] (у этих белков обычно есть и небольшие гидрофильные участки).
Денатурация
Простые и сложные белки
В состав многих белков помимо пептидных цепей входят и неаминокислотные фрагменты, по этому критерию белки классифицируют на две большие группы — простые и сложные белки (протеиды). Простые белки содержат только аминокислотные цепи, сложные белки содержат также неаминокислотные фрагменты. Эти фрагменты небелковой природы в составе сложных белков называются «простетическими группами». В зависимости от химической природы простетических групп среди сложных белков выделяют следующие классы:
Структура белка
Молекулы белков представляют собой линейные полимеры, состоящие из α-L-аминокислот (которые являются мономерами) и, в некоторых случаях, из модифицированных основных аминокислот (правда, модификации происходят уже после синтеза белка на рибосоме). Для обозначения аминокислот в научной литературе используются одно- или трёхбуквенные сокращения. Хотя на первый взгляд может показаться, что использование в большинстве белков «всего» 20 видов аминокислот ограничивает разнообразие белковых структур, на самом деле количество вариантов трудно переоценить: для цепочки всего из 5 аминокислот оно составляет уже более 3 миллионов, а цепочка из 100 аминокислот (небольшой белок) может быть представлена более чем в 10 130 вариантах. Белки длиной от 2 до нескольких десятков аминокислотных остатков часто называют пептидами, при большей степени полимеризации — белками, хотя это деление весьма условно.
Такой трёхкодонный код сложился эволюционно рано. Но существование различий в некоторых организмах, появившихся на разных эволюционных стадиях, указывает на то, что он был не всегда таким.
Согласно некоторым моделям, сначала код существовал в примитивном виде, когда малое число кодонов обозначало сравнительно небольшое число аминокислот. Более точное значение кодонов и большее число аминокислот могли быть введены позже. Сначала только первые два из трёх оснований могли быть использованы для узнавания [что зависит от структуры тРНК].
Гомологичные белки (предположительно имеющие общее эволюционное происхождение и нередко выполняющие одну и ту же функцию), например, гемоглобины разных организмов, имеют во многих местах цепи идентичные, консервативные остатки аминокислот. В других местах находятся различные аминокислотные остатки, называемые вариабельными. По степени гомологии (сходства аминокислотной последовательности) возможна оценка эволюционного расстояния между таксонами, к которым принадлежат сравниваемые организмы.
Уровни организации
Окружение белков
По общему типу строения белки можно разбить на три группы:
Образование и поддержание структуры белков в живых организмах
Синтез белков
Химический синтез
Биосинтез белков
Универсальный способ: рибосомный синтез
Белки синтезируются живыми организмами из аминокислот на основе информации, закодированной в генах. Каждый белок состоит из уникальной последовательности аминокислот, которая определяется нуклеотидной последовательностью гена, кодирующего данный белок. Генетический код составляется из трёхбуквенных «слов», называемых кодонами; каждый кодон отвечает за присоединение к белку одной аминокислоты: например, сочетание АУГ соответствует метионину. Поскольку ДНК состоит из четырёх типов нуклеотидов, то общее число возможных кодонов равно 64; а так как в белках используется 20 аминокислот, то многие аминокислоты определяются более чем одним кодоном. Гены, кодирующие белки, сначала транскрибируются в последовательность нуклеотидов матричной РНК (мРНК) белками РНК-полимеразами.
Процесс синтеза белка на основе молекулы мРНК называется трансляцией. Во время начальной стадии биосинтеза белков, инициации, обычно метиониновый кодон узнаётся малой субъединицей рибосомы, к которой при помощи белковых факторов инициации присоединена метиониновая транспортная РНК (тРНК). После узнавания стартового кодона к малой субъединице присоединяется большая субъединица и начинается вторая стадия трансляции — элонгация. При каждом движении рибосомы от 5′ к 3′ концу мРНК считывается один кодон путём образования водородных связей между тремя нуклеотидами (кодоном) мРНК и комплементарным ему антикодоном транспортной РНК, к которой присоединена соответствующая аминокислота. Синтез пептидной связи катализируется рибосомальной РНК (рРНК), образующей пептидилтрансферазный центр рибосомы. Рибосомальная РНК катализирует образование пептидной связи между последней аминокислотой растущего пептида и аминокислотой, присоединённой к тРНК, позиционируя атомы азота и углерода в положении, благоприятном для прохождения реакции. Ферменты аминоацил-тРНК-синтетазы присоединяют аминокислоты к их тРНК. Третья и последняя стадия трансляции, терминация, происходит при достижении рибосомой стоп-кодона, после чего белковые факторы терминации гидролизуют последнюю тРНК от белка, прекращая его синтез. Таким образом, в рибосомах белки всегда синтезируются от N- к C-концу.
Нерибосомный синтез
Внутриклеточный транспорт и сортировка белков
Синтезируемые в цитоплазме на рибосомах белки должны попадать в разные компартменты клетки — ядро, митохондрии, эндоплазматический ретикулум (ЭПР), аппарат Гольджи, лизосомы и др., а некоторые белки должны попасть во внеклеточную среду. Для попадания в определённый компартмент белок должен обладать специфической меткой. В большинстве случаев такой меткой является часть аминокислотной последовательности самого белка (лидерный пептид, или сигнальная последовательность белка). В некоторых случаях меткой служат посттрансляционно присоединённые к белку олигосахариды. Транспорт белков в ЭПР осуществляется по мере их синтеза, так как рибосомы, синтезирующие белки с сигнальной последовательностью для ЭПР, «садятся» на специальные транслокационные комплексы на мембране ЭПР. Из ЭПР в аппарат Гольджи, а оттуда в лизосомы, на внешнюю мембрану или во внеклеточную среду белки попадают путём везикулярного транспорта. В ядро белки, обладающие сигнальной последовательностью для ядра, попадают через ядерные поры. В митохондрии и хлоропласты белки, обладающие соответствующими сигнальными последовательностями, попадают через специфические белковые поры-транслокаторы при участии шаперонов.
Посттрансляционная модификация белков
После завершения трансляции и высвобождения белка из рибосомы аминокислоты в составе полипептидной цепи подвергаются разнообразным химическим модификациям. Примерами посттрансляционной модификации являются:
Функции белков в организме
Так же как и другие биологические макромолекулы (полисахариды, липиды) и нуклеиновые кислоты, белки — необходимые компоненты всех живых организмов, они участвуют в большинстве жизненных процессов клетки. Белки осуществляют обмен веществ и энергетические превращения. Белки входят в состав клеточных структур — органелл, секретируются во внеклеточное пространство для обмена сигналами между клетками, гидролиза пищи и образования межклеточного вещества.
Каталитическая функция
Структурная функция
Защитная функция
Существуют несколько видов защитных функций белков:
Регуляторная функция
Многие процессы внутри клеток регулируются белковыми молекулами, которые не служат ни источником энергии, ни строительным материалом для клетки. Эти белки регулируют транскрипцию, трансляцию, сплайсинг, а также активность других белков и др. Регуляторную функцию белки осуществляют либо за счёт ферментативной активности (например, протеинкиназы), либо за счёт специфического связывания с другими молекулами, как правило, влияющего на взаимодействие с этими молекулами ферментов.
Сигнальная функция
Сигнальная функция белков — способность белков служить сигнальными веществами, передавая сигналы между клетками, тканями, о́рганами и разными организмами. Часто сигнальную функцию объединяют с регуляторной, так как многие внутриклеточные регуляторные белки тоже осуществляют передачу сигналов.
Сигнальную функцию выполняют белки-гормоны, цитокины, факторы роста и др.
Гормоны переносятся кровью. Большинство гормонов животных — это белки или пептиды. Связывание гормона с рецептором является сигналом, запускающим в клетке ответную реакцию. Гормоны регулируют концентрации веществ в крови и клетках, рост, размножение и другие процессы. Примером таких белков служит инсулин, который регулирует концентрацию глюкозы в крови.
Клетки взаимодействуют друг с другом с помощью сигнальных белков, передаваемых через межклеточное вещество. К таким белкам относятся, например, цитокины и факторы роста.
Транспортная функция
Запасная (резервная) функция белков
К таким белкам относятся так называемые резервные белки, которые запасаются в качестве источника энергии и вещества в семенах растений и яйцеклетках животных; белки третичных оболочек яйца (овальбумины) и основной белок молока (казеин) также выполняют, главным образом, питательную функцию. Ряд других белков используется в организме в качестве источника аминокислот, которые в свою очередь являются предшественниками биологически активных веществ, регулирующих процессы метаболизма.
Рецепторная функция
Моторная (двигательная) функция
Белки в обмене веществ
Аминокислоты, которые не могут быть синтезированы животными, называются незаменимыми. Основные ферменты в биосинтетических путях, например, аспартаткиназа, которая катализирует первый этап в образовании лизина, метионина и треонина из аспартата, отсутствуют у животных.
Единых норм потребления белков человеком нет. Микрофлора толстого кишечника синтезирует аминокислоты, которые не учитываются при составлении белковых норм.
Биофизика белка
Методы изучения
Седиментационный анализ (центрифугирование) позволяет делить белки по размерам, различая белки по значению их константы седиментации, измеряемой в сведбергах (S).
Для определения количества белка в образце используют ряд методик: [64]