Что такое бактериофаг в медицине
Бактериофаготерапия на современном этапе
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Введение
Человек живет впостоянном контакте исложнейшем взаимодействии снеисчислимым множеством микроорганизмов. Жить без микробов невозможно, ноисмногими изних— тоже. Ежегодно, посамым скромным оценкам, неучитывающим недоступные для статистики ВОЗ данные многих развивающихся стран, погибает отпневмонии 3,9млн человек, отдиареи— 1,6млн, оттуберкулеза— 1,6млн [1].
Человек живет в постоянном контакте и сложнейшем взаимодействии с неисчислимым множеством микроорганизмов. Жить без микробов невозможно, но и с многими из них — тоже. Ежегодно, по самым скромным оценкам, не учитывающим недоступные для статистики ВОЗ данные многих развивающихся стран, погибает от пневмонии 3,9 млн человек, от диареи — 1,6 млн, от туберкулеза — 1,6 млн [1].
С учетом нарастающей резистентности флоры к антибиотикам, вероятности аллергических и токсических реакций возникает проблема: что применять вместо антибиотиков или в комплексе с ними?
Строение и микробиология фага
Бактериофаги — древнейшие вирусы, наиболее распространенный в биосфере биологический объект. Чистая природная вода содержит в 1 мл 2×108 фагов, на каждую бактериальную единицу приходится не менее 10 фаговых [5, 6].
Принципы выбора терапии бактериофагами
В многочисленных отечественных и зарубежных публикациях продемонстрирована эффективность применения бактериофагов, генетически модифицированных, в лечении поверхностной и системной инфекций [8, 9]. Лечение фагами привлекательно по следующим причинам:
1. Бактериофаги высокоспецифичны и лизируют только «вредные микробы». Специфичность фагов варьирует от крайне избирательной к определенным бактериям (используется в типировании микробов) до относительно широкого спектра лизируемых бактерий. Но даже в этом случае широта воздействия не достигает широты действия антибиотиков. Поэтому, например, при лечении фагами не изменяется естественная флора кишечника, а для лечения инфекций требуется препарат, содержащий несколько фагов (по аналогии с поливалентным препаратом Секстафаг® (пиобактериофаг поливалентный)).
3. Бактериофаги эффективны против микробов. Частота выделения мультирезистентной флоры варьирует, по данным разных клиник, от менее 1 до 42% [10, 11], что определяется, по нашему мнению, только профилем клиники и контингентом пациентов. В условиях нарастающей резистентности бактериальной флоры к антибиотикам многие авторы рассматривают фаготерапию как решение проблемы. Бактериофаги «чисты», безопасны в применении.
При применении бактериофагов следует учитывать, что специфичность фагов может ограничивать их применение в острых случаях.
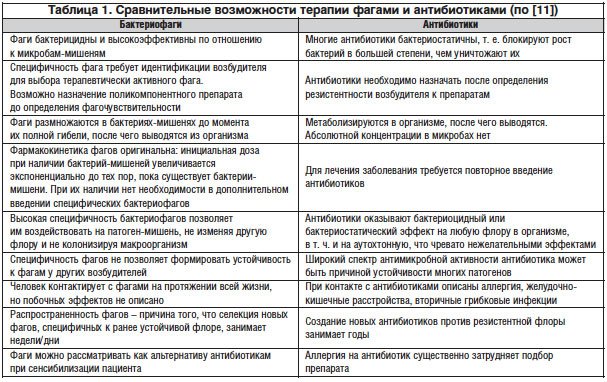
Соотношение бактериофаго- и антибиотикотерапии представлено в таблице 1.
Фаготерапия покровных и барьерных структур тканей
В эксперименте [14, 15] была показана эффективность фагов в лечении кожных инфекций и внутримышечных абсцессов (Pseudomonas (Ps.) aeruginosa, Staphylococcus (S.) aureus). В клинической практике эффективность лечения инфекций ран, инфицированных пострадиационных некрозов была продемонстрирована K. Markoishwili et al. [16] и другими представителями школы грузинского ученого Г. Элиавы.
В нашей стране для наружного применения используют комплексные фаговые препараты. Препарат пиобактериофаг поливалентный (Секстафаг®) для приема внутрь (20 мл 3 р./сут, 7–15 дней), местно или наружно способен лизировать стафило- и стрептококки, патогенные кишечные и синегнойные бактерии (Proteus mirabilis, Proteus vulgaris, Klebsiella pneumoniae). Это позволяет применять его при заболеваниях уха, горла, носа, дыхательных путей, легких и плевры (воспалении пазух носа, среднего уха, ангине, фарингите, ларингите, трахеите, бронхите, пневмонии, плеврите). Секстафаг®, являясь эффективной альтернативой антибиотикам, может также применяться с ними комплексно. Крайне важно, что препарат может применяться при заболеваниях у новорожденных и детей грудного возраста (омфалит, гастроэнтероколит), беременных и рожениц. Все это подчеркивает безопасность препарата.
Гель Отофаг применяют местно в дозировке 1–2 мл: для профилактики рецидивов заболеваний — 2–3 р./сут в течение 7–10 дней, при наличии бактериального воспалительного заболевания — 2–3 р./сут в течение 7–14 дней.
Применение фагов как профилактического, лечебного и противорецидивного средства продемонстрировало свою эффективность в самой частой педиатрической группе: пациенты с инфекционной патологией верхних дыхательных путей (риносинуситы, тонзиллиты, ларингиты, фарингиты). Обычно эти инфекции трактуются как вирусные, хотя достаточно часто причиной бывают и бактерии, или бактериальная флора активируется в процессе манифестации вирусной инфекции.
Подавляющее большинство всех случаев острых заболеваний детей, особенно младшего возраста, вызваны острой респираторной инфекцией (ОРИ). Первичная заболеваемость детей и подростков по г. Москве за колебалась от 1680,2‰ до 1763,6‰3. Заболеваемость болезнями органов дыхания за этот же период составила 1147,4–1188,8‰. Общий экономический ущерб от заболеваний гриппом детей и взрослых в 2008 г. составил 375,2 млрд руб. Заболеваемость ОРВИ детей и подростков до 17 лет в 8,3 раза выше, чем взрослых. Так, при совместных исследованиях с [17] было показано, что на первом году жизни частота эпизодов ОРИ составляет 1535,9:1000, у детей достигает 3796,29:1000. Даже если первоначально заболевание разворачивается как вирусное, то впоследствии часто присоединяется бактериальная флора или активируется собственная, что требует взвешенного решения о выборе препарата или сочетании антибиотиков с иными препаратами, бактериофагами.
Инфекционный ринит дебютирует первоначально, как правило, как вирусный с типичным водянистым или отделяемым. Появление отделяемого, лихорадки, боли в области придаточных пазух говорит о присоединении бактериальной флоры. В качестве профилактики такого развития заболевания можно обсуждать местное применение поливалентного бактериофага.
Присоединение бактериальной инфекции с ее распространением на придаточные пазухи носа приводит к синуситу. Любые нарушения цилиарного клиренса, вентиляции, местного или системного иммунного ответа создают условия для хронизации синусита, вылечить который без воздействия на первоначальные причины невозможно. Признаки синусита:
К признакам тяжелого течения синусита или его осложнений относятся гнойная ринорея, лихорадка выше 39ºС и периорбитальный отек. При остром и подостром синусите чаще обнаруживают Streptococcus pneumoniae, реже — Haemophilus (H.) influenzae, Moraxella catarrhalis, Streptococcus pyogenes (β-гемолитический). Хронический синусит чаще полимикробный, вызывается α-гемолитическим стрептококком, S. aureus, коагулазонегативными стафилококками, нетипичными H. influenzae, а также Moraxella catarrhalis и анаэробными бактериями (Peptostreptococcus spp., Prevotella, Bacteroides, Fusobacterium spр.), после многих курсов антибиотиков (или у иммунокомпрометированных пациентов) — Pseudomonads. Эти сведения еще раз заставляют оценить место и роль поливалентных бактериофагов в комплексном лечении синуситов.
При лечении риносинуситов препаратом пиобактериофаг путем его местного введения в пазухи отмечено значительное улучшение, нормализовались показатели завершенности фагоцитоза, что указывало на снижение интенсивности воспаления с восстановлением адекватного иммунного ответа слизистых оболочек носа. Таким образом, препарат пиобактериофаг поливалентный (Секстафаг®) обладает противовоспалительными и иммунорегуляторными свойствами, что проявляется нормализацией показателей местного иммунитета. В то же время применение антибиотиков при лечении больных хроническим гнойным риносинуситом сопровождается сохранением признаков воспаления в виде активации нейтрофильного звена иммунной системы, увеличением внеклеточной пероксидазной активности и угнетением процесса фагоцитоза с нарушением механизмов завершенности в клетках [18]. Пиобактериофаг при местном введении в пазухи улучшает показатели завершенности фагоцитоза, что свидетельствует о снижении интенсивности воспаления с восстановлением адекватного иммунного ответа слизистых оболочек носа [19].
Большой проблемой педиатрии являются тонзиллофарингиты, аденоидиты. За 1 год не менее 10% всей детской популяции переносят тонзиллофарингит, из них у 25–50% причиной является стрептококк группы А. 20% здоровых детей являются носителями стрептококка, А [20, 21]. Хроническая гипертрофия аденоидных вегетаций может приводить к нарушению естественного дренирования евстахиевых труб и восхождению инфекции в среднее ухо. Рецидивирующий аденоидит — самая частая причина кашля у детей: стекающая с воспаленной поверхности небной миндалины слизь («постназальная капель») раздражает верхние дыхательные пути и вызывает кашель. Чаще всего на аденоидных вегетациях обнаруживают H. influenzae, Streptococcus (S.) β-hemolytic гр. А, S. aureus, Moraxella (M.) catarrhalis, Streptococcus (S.) pneumoniae (по убывающей). При аденоидитах причинами среднего отита и риносинусита у детей чаще бывают антибиотикорезистентные H. influenzae, M. catarrhalis, S. pneumoniae [22]. Безусловно, это служит основанием для топического применения специфических фагов, хотя и отечественные авторы, с надеждой указывающие на это направление, ссылаются на недостаточную доказательность фаготерапии хронического аденоидита в детской практике [23]. Другие исследователи более оптимистичны. Показано, что введение в комплекс терапии при хроническом аденоидите местного бактериофага приводило к существенному улучшению результатов [24]. Но непосредственный эффект лечения и отдаленные последствия, видимо, во многом определяются генетически. В сравнительном исследовании по проверке гипотезы положительного влияния хирургического удаления аденоидов и миндалин на вероятность развития осложнений, связанных со стрептококковой инфекцией, показано, что значительной разницы в титре антистрептококковых антител, связанных со S. β-hemolytic гр. А детских аутоиммунных нейропсихиатрических нарушений, расстройств и тиков между оперированными и неоперированными детьми нет [25].
При обследовании пациентов с компенсированной формой хронического тонзиллита S. aureus выделен у 92,5%. Чувствительность культур золотистого стафилококка к стафилококковому бактериофагу оказалась очень высокой (97,4%). По результатам монотерапии специфическим бактериофагом и комбинированного лечения зарегистрированы клиническое улучшение и уменьшение высеваемости S. aureus со слизистой оболочки миндалин [26].
Обострения хронического ларингита сопровождается обсеменением слизистой гортани патогенной микрофлорой. Использование в комплексном лечении таких пациентов специфического бактериофага в виде инстилляций в гортань, а в случае тяжелого обострения — в виде приема внутрь позволяет существенно сократить продолжительность лечения, значительно повышая его качество, достичь более длительной ремиссии болезни и снизить частоту обострений [27].
Эффективность бактериофаготерапии у иммунокомпрометированных пациентов доказана в зарубежных исследованиях [28].
Бактериофаги продемонстрировали эффективность при лечении инфекции, находящейся под биопленкой. Биопленка — плотная колония микроорганизмов на поверхности биологических или небиологических сред, окружающих себя секретируемым экстрацеллюлярным полимером, практически непроницаемым для антибиотиков. Способность бактерий образовывать биопленку — важнейшее условие их выживания на поверхности тканей или медицинских объектов (катетеры, имплантаты). свойства биопленок позволили выдвинуть идею о кооперированных микробных группах как аналогах многоклеточных организмов и социобиологических общностей [29]. Разрушение биопленки возможно при применении фагов [30]. В частности, обработка катетеров перед их постановкой коагулазонегативными фагами резко снижает вероятность образования биопленки Staphylococcus epidermidis [31].
Применение бактериофагов известно также при собственно кишечных инфекциях [32] и при сепсисе, вызванном кишечной инфекцией Ps. aeruginosa [33]. При этом в эксперименте прием бактериофага per os привел к 67% выживаемости в экспериментальной группе животных и к 0% в контрольной.
Особое внимание привлекает возможность бактериофаготерапии при внутренних и системных инфекциях. Большинство таких исследований принадлежит отечественным ученым. Показано, что совместное применение бактериофагов и антибиотиков в лечении детей с осложненной инфекцией мочевыводящих путей значительно эффективней, чем изолированная антибиотикотерапия [34].
[35] пролечено 36 детей в возрасте от 14 дней до 3 лет с тяжелыми заболеваниями бронхолегочной системы с наличием в мокроте синегнойной и кишечной палочек, клебсиеллы, энтерококка, стафилококка, которые, будучи нозокомиальной флорой, в большинстве случаев были нечувствительны к большинству известных антибиотиков. Путем ингаляций вводили моно- или поливалентные бактериофаги, пиобактериофаг. Курс антибактериальной терапии сократился с 13–17 до 8–11 дней. Элиминация возбудителя и уменьшение воспаления в трахеобронхиальном дереве подтверждались контрольным бактериологическим посевом и цитологическим исследованием мокроты: эффективность составила 88,8%. Использование поливалентных фагов явилось более оправданным по сравнению с монофагами на фоне элиминации основного бактериального агента в меньшей мере происходила параллельная контаминация другими, не менее вирулентными, микробами. Таким образом, применение небулайзеротерапии бактериофагами в комплексном лечении острых и хронических обструктивных бронхолегочных заболеваний, включая муковисцидоз, показало высокую клиническую эффективность, позволило сократить сроки лечения дорогостоящими антибиотиками широкого спектра, уменьшить риск развития кандидоза. В эксперименте на животных, моделирующем лечение муковисцидоза, введение бактериофага при тяжелой пневмонии, вызванной Ps. aeruginosa, сопровождалось резким повышением выживаемости в подопытной группе [36].
Есть много нерешенных проблем, которые сводятся к организации многоцентровых исследований по принципам доказательной медицины, соотношению антибиотиков и бактериофагов при лечении.
В любом случае можно утверждать, что это направление перспективно и достаточно обнадеживающе, особенно при инфицировании резистентными штаммами.
Разнообразие лекарственных форм бактериофагов (таблетки, гели, растворы) позволяет применять их как перорально, так и наносить на раневые поверхности, вводить в полости организма. Препараты бактериофагов широко применяются в педиатрии, акушерстве и гинекологии, офтальмологии Например, назначение по поводу кесарева сечения препарата Секстафаг®, предварительно адаптированного к флоре, циркулирующей в конкретном учреждении, приводило к снижению осложнений (18,7%) в большей степени (26,7%), чем в группе женщин, получавших антибиотикопрофилактику.
Заключение
В настоящее время в большинстве публикаций указывается на безопасность фаготерапии; хорошо организованные двойные слепые рандомизированные контролируемые исследования позволят определить безопасность и эффективность фагов как альтернативы антибиотикам при инфекциях с полирезистентной флорой [39]. Дальнейшее изучение возможностей бактериофаготерапии будет зависеть от объективной заинтересованности медицинского сообщества, проведения многоцентровых независимых исследований, развития вирусологии с ее возможностями получения новых чистых препаратов фагов.
1 Сборник среднемосковских основных показателей деятельности учреждений Департамента здравоохранения г. Москвы за М., 2009. 87 с.
2 Выбор инфекционного агента для опытов не был случайным: отец был известным микробиологом, написавшим монографию о сибиреязвенной палочке, переведенную и на немецкий язык.
3 Департамент здравоохранения г. Москвы. Доклад о состоянии здоровья населения г. Москвы в 2008 г.
Только для зарегистрированных пользователей
Секстафаг пиобактериофаг поливалентный : инструкция по применению
Описание
Бактериофаг представляет собой прозрачную жидкость желтого цвета различной интенсивности, возможен зеленоватый оттенок.
Пиобактериофаг поливалентный обладает способностью специфически лизировать бактерии стафилококков, стрептококков (в том числе энтерококков), протея, клебсиелл пневмонии, синегнойной и кишечной палочек.
Состав
В 1 мл препарата содержится:
Фармакотерапевтическая группа
Прочие терапевтические средства.
Классификация по ICTV: Caudovirales.
Фармакологические свойства
Фармакодинамика. Активность бактериофага при наличии фагочувствительности бактериального штамма проявляется в виде проникновения, внутриклеточного размножения, разрушения бактериальной клетки и выхода фаговых частиц, готовых к заражению новых бактериальных клеток.
После перорального однократного приема бактериофага, фаговые частицы обнаруживаются через 1 час в образцах крови, через 1-1,5 часа на поверхности ожоговых ран и в бронхиальном содержимом, через 2 часа в ликворе и моче. В каловых массах выявлялось фаговых частиц в 3 раза больше, чем в моче.
По данным литературы, клиническая эффективность фаготерапии сопоставима с результатами лечения у пациентов, получающих антибиотикотерапию.
Фармакокинетика. Исследования по фармакокинетике, проведенные на лабораторных животных доказали, что бактериофаг, введенный любым способом, поступает в общий ток крови, но обычно в крови не задерживается, а адсорбируется различными тканями, оседая в первую очередь в лимфатических узлах, в печени и селезенке. Выведение из организма происходит через кишечник и почки.
По литературным данным длительность пребывания бактериофагов и уровень выхода фагов зависят от присутствия гомологичного фагочувствительного штамма-возбудителя инфекции в организме. При отсутствии гомологичного возбудителя через 2 часа после однократного приема наблюдается массивное выделение фагов с мочой, снижающееся до единичных к концу первых суток. Однако низкий уровень выхода фагов может поддерживаться до 6 суток. Высокое содержание фаговых частиц в образцах и длительное его выделение свидетельствует о происходящем в организме процессе размножения бактериофагов в очаге инфекции.
У урологических больных наблюдается тенденция нарастания титра фаговых частиц в крови, достигающая массивного присутствия к 8-10 часам после приема препарата. Длительность обнаружения фага варьирует от 2 до 6-7 суток. У всех больных снижение количества бактериофага сопутствовало снижению уровня бактериурии.
Гематоэнцефалический барьер у здорового животного является барьером для проникновения фагов в центральную нервную систему. Нарушение центрального барьера даже в слабой степени влечет за собой поступление бактериофага из кровяного русла в ликвор.
Показания к применению
Лечение и профилактика гнойно-воспалительных и энтеральных заболеваний, вызванных стафилококками, стрептококками, протеями, клебсиеллами, синегнойной и кишечной палочками:
— посттравматические конъюктивиты, кератоконъюктивиты, гнойные язвы роговицы и иридоциклиты;
— генерализованные септические заболевания;
— другие заболевания, вызванные бактериями стафилококков, стрептококков (в том числе энтерококков), протея, клебсиелл пневмонии, синегнойной и кишечной палочек.
При тяжелых проявлениях инфекций, вызванных стафилококками, стрептококками, протеем, клебсиеллой пневмонии, синегнойной и кишечной палочками, препарат назначается в составе комплексной терапии.
С профилактической целью препарат используют для обработки операционных и свежеинфицированных ран, а также для профилактики внутрибольничных инфекций по эпидемическим показаниям.
Важным условием эффективной фаготерапии является предварительное определение фагочувствительности возбудителя.
Способ применения и дозировка
Перед использованием флакон с бактериофагом необходимо взболтать и просмотреть. Препарат должен быть прозрачным и не содержать осадка.
Лечение гнойно-воспалительных заболеваний с локализованными поражениями должно проводиться одновременно как местно, так и приемом препарата внутрь в течение 7-20 дней (по клиническим показаниям).
В зависимости от характера очага инфекции бактериофаг применяют:
1. Местно в виде орошения, примочек и тампонирования жидким фагом в количестве до 200 мл в зависимости от размеров пораженного участка. При абсцессах бактериофаг вводят в полость очага после удаления гноя с помощью пункции. Количество вводимого препарата должно быть несколько меньше объема удаленного гноя. При остеомиелите после соответствующей хирургической обработки в рану вливают бактериофаг по 10-20 мл.
3. При циститах, пиелонефритах, уретритах препарат принимают внутрь. В случае, если полость мочевого пузыря или почечной лоханки дренированы, бактериофаг вводят через цистостому или нефростому 1-2 раза в день по 20-50 мл в мочевой пузырь и по 5-7 мл в почечную лоханку.
4. При гнойно-воспалительных гинекологических заболеваниях препарат вводят в полость вагины, матки в дозе 5-10 мл ежедневно однократно.
5. При гнойно-воспалительных заболеваниях уха, горла, носа препарат вводят в дозе 2-10 мл 1-3 раза в день. Бактериофаг используют для полоскания, промывания, закапывания, введения смоченных турунд (оставляя их на 1 час).
7. При лечении стоматитов и хронических генерализованных пародонтитов препарат используют в виде полосканий полости рта 3-4 раза в день в дозе 10-20 мл, а также введением в пародонтальные карманы турунд, пропитанных пиобактериофагом, на 5-10 минут.
8. При кишечных формах заболевания, заболеваниях внутренних органов, дисбактериозе бактериофаг применяют через рот и в виде клизм в течение 7-20 дней. Через рот бактериофаг дают 3 раза в сутки натощак за 1 час до еды. В виде клизм назначают 1 раз в день вместо одного приема через рот.
Рекомендуемые дозировки препарата
| Возраст пациента | Доза на 1 прием (мл) | |
| Внутрь | В клизме | |
| 0-6 мес. | 5 | 10 |
| 6-12 мес. | 10 | 20 |
| От 1 года до 3 лет | 15 | 20-30 |
| От 3- до 8 лет | 20 | 30-40 |
| От 8 лет и старше | 20-30 | 40-50 |
В случае, если до применения бактериофага для лечения ран применялись химические антисептики, рана должна быть тщательно промыта стерильным 0,9% раствором натрия хлорида.
Применение бактериофага у детей (до 6 месяцев). При сепсисе, энтероколите новорожденных, включая недоношенных детей, бактериофаг применяют в виде высоких клизм (через газоотводную трубку или катетер) 2-3 раза в сутки (см. табл.). При отсутствии рвоты и срыгивания возможно применение препарата через рот. В этом случае он смешивается с грудным молоком. Возможно сочетание ректального (в клизмах) и перорального (через рот) применения препарата. Курс лечения 5-15 дней. При рецидивирующем течении заболевания возможно проведение повторных курсов лечения. С целью профилактики сепсиса и энтероколита при внутриутробном инфицировании или опасности возникновения внутрибольничной инфекции у новорожденных детей бактериофаг применяют в виде клизм 2 раза в день в течение 5-7 дней.
При лечении омфалитов, пиодермий, инфицированных ран препарат применяют в виде аппликаций ежедневно двукратно (марлевую салфетку смачивают бактериофагом и накладывают на пупочную ранку или на пораженный участок кожи).
Место бактериофагов в терапии инфекционных заболеваний желудочно-кишечного тракта
Место бактериофагов в терапии инфекционных заболеваний желудочно-кишечного тракта
Наиболее дискутабельным остается вопрос о целесообразности использования антимикробных препаратов (АМП) в лечении бактериальных ОКИ у детей. Назначая АМП в этих случаях, врач ожидает: уменьшения выраженности клинических симптомов, сокращения продолжительности заболевания, снижения частоты развития осложнений, прекращения выделения возбудителя, предупреждения дальнейшего распространения инфекции [4, 5].
В то же время доказано, что использование антибиотиков далеко не всегда является эффективным и безопасным при бактериальной диарее. Так, при энтерогеморрагическом эшерихиозе применение АМП приводит к массивному высвобождению шигаподобного токсина, следовательно, увеличивает риск развития гемолитико-уремического синдрома [6].
Назначение АМП при бактериальных диареях в значительном проценте случаев не только не приводит к санации макроорганизма от возбудителя, а, наоборот, способствует продолжительной персистенции бактериального агента в желудочно-кишечном тракте (ЖКТ) вследствие не только подавляющего влияния на аутохтонную микробиоту кишечника, но и прямого иммуносупрессивного действия [7, 8]. По данным отечественных и зарубежных исследователей, затяжное реконвалесцентное бактериовыделение сальмонелл формируется у значительного числа пациентов, получавших антибиотики в острую фазу инфекции, по сравнению с лицами, использующими исключительно
патогенетическую терапию [9, 10].
Экономический ущерб, наносимый возникновением антибиотикорезистентных форм бактерий, исчисляется десятками и сотнями миллионов долларов. Например, в странах Евросоюза он составляет как минимум 1,5 млрд. евро в год [11]. В сложившейся ситуации альтернативу АМП в терапии бактериальных диарей могут составить бактериофаги [12, 13].
Необходимо отметить, что в медицинском сообществе в настоящее время присутствует две полярные точки зрения на роль и место бактериофагов в терапии инфекционных заболеваний. Часть специалистов, ориентируясь на зарубежные протоколы и гадлайны, считают использование бактериофагов архаичным и небезопасным наследием прошлых десятилетий советской медицины; другие – широко применяют препараты фагов в своей клинической практике без каких-либо сомнений и при этом не опираются на исследования чувствительности и эффективности терапии.
Автору пришлось неоднократно беседовать с представителями обеих групп специалистов, и оказалось, что в большинстве случаев мало кто из них мог правильно ответить на вопрос, что представляют собой бактериофаги и каков их механизм действия. Бактериофаги – это вирусы, избирательно поражающие бактериальные клетки. В первую очередь необходимо понимать, что бактериофаги – это древние обитатели планеты и каждый грамм почвы, каждый кубический сантиметр воды и воздуха, продукты питания,
растения, животные содержат миллионы фаговых частиц (от 10 до 100 млн). Фаговые частицы в огромном количестве содержатся на кожных покровах, слизистых оболочках и в открытых полостях организма человека. Бактериофаги – самые вездесущие и наиболее распространенные существа на Земле, их насчитывают 1030–1032. Доказано, что бактериофаги играют важную роль в эволюции бактерий и реализации их патогенных свойств. Фаги способствуют формированию генетического разнообразия бактерий [14–16].
Выделяют вирулентные и умеренные бактериофаги. Вирулентные фаги: заражение бактерий ими всегда заканчивается разрушением бактерий и высвобождением зрелых фаговых частиц, готовых к поражению новых бактериальных клеток, – литический эффект. Умеренные бактериофаги: генетический материал фагов включается в хромосомы бактерий, такие фаги называются профагами и вызывают лизогенный эффект (лизогенную конверсию). Умеренные фаги интегрируются в бактериальную хромосому и размножаются синхронно с клеткой хозяина, не вызывая лизиса долгое время. Умеренные фаги могут переносить хозяйские гены (гены бактериальной клетки) от одной
бактериальной клетки к другой (фаговая трансдукция).
В настоящее время доказано, что множество факторов вирулентности у патогенных и условно-патогенных бактерий закодировано с помощью профаговых генов.
Так у Vibrio cholerae, Clostridium botulinum продукция токсинов обусловлена профагами [15, 16].
Бактериофаги – это высокоэффективные иммунобиологические препараты антимикробного действия, применяются для лечения и профилактики бактериальных инфекций, в том числе инфекций, связанных с оказанием медицинской помощи. Антимикробный эффект бактериофагов обусловлен внедрением фага в бактериальную клетку с последующим его размножением и лизисом инфицированной клетки. Вышедшие во внешнюю среду в результате лизиса бактериофаги повторно инфицируют и лизируют другие бактериальные клетки, действуя до полного уничтожения патогенных бактерий в очаге воспаления [14–17]. В настоящее время описано 13 семейств бактериофагов,
подразделенных более чем на 140 родов, содержащих более 5300 видов.
Бактериофаги широко применялись для лечения разных заболеваний с 1920-х годов как в СССР, так и зарубежных странах. Символично, что в 1930–1932 гг. Моррисон впервые применил массовую фаготерапию во время эпидемии холеры в Индии, затем долгие годы ученые считали, что с помощью бактериофагов можно управлять эпидемическим процессом при холере, однако эти мировоззрения оказались ошибочными [18].
Однако с 1940–1950-х годов производство и применение фагов на Западе практически прекратились. Препараты бактериофагов на сегодняшний день производятся лишь в России, Грузии и Польше. Однако в настоящее время интерес к бактериофагам возрождается во всем мире. Так, в 2006 г. Управление по контролю за продуктами и лекарствами Соединенных Штатов разрешило использование бактериофагов Listeria monocytogenes в качестве антимикробного компонента в сырах, а в 2007 г. – во всех готовых к употреблению продуктах. Препарат выпускается компанией Intralytix Inc. (США) и представляет собой смесь из шести фагов, активных в отношении L. monocytogenes. По инициативе этой же компании в 2008 г. была завершена I фаза клинических исследований препарата бактериофагов, содержащего восемь фагов, специфически лизирующих Pseudomonas aeruginosa, S. aureus и E. coli. Показана безопасность этого препарата при лечении венозных язв [18]. В августе 2009 г. корпорацией Nestlé Nutrition (Швейцария) в Бангладеш были инициированы клинические исследования по изучению безопасности и эффективности применения бактериофага E. coli в терапии ОКИ у детей в возрасте от 6 до 60 мес [19].
В настоящее время бактериофаги используются в качестве АМП при разных бактериальных инфекциях: желудочно-кишечного тракта (ЖКТ), ЛОР-органов, органа зрения, дыхательных путей, урогенитального тракта, генерализованных септических заболеваний, ожоговых ранах, хирургических инфекциях; для профилактики инфекций, связанных с оказанием медицинской помощи [20].
Фаги проникают через эпителиальные барьеры слизистых оболочек с помощью рецепторзависимого транспорта, активно осуществляемого специализированными клетками иммунной системы (М-клетками, бокаловидными) и, возможно, клетками эпителия кишечника и других отделов ЖКТ. Бактериофаг, введенный любым способом, поступает в общий ток крови, в крови не задерживается и адсорбируется тканями, оседая в первую очередь в лимфатических узлах, печени и селезенке. Выводится фаг из организма через кишечник и почки. После перорального приема фаговые частицы обнаруживаются через 1 ч в образцах крови, через 1–1,5 ч – на поверхности ожоговых ран и в бронхиальном содержимом, через 2 ч – в ликворе и моче. После однократного приема больными пациентами фаги выделялись с мочой в течение 5–6 сут с постепенным уменьшением титра. Гематоэнцефалический барьер не является барьером для проникновения фагов в центральную нервную систему. Необходимо отметить, что
скорость транслокации фагов, так же как и бактерий из ЖКТ в кровь, может существенно меняться в разных физиологических состояниях. При воспалительном ответе транслокация бактерий и, вероятно, фагов из кишечника значительно увеличивается [18].
Бактериофаги, используемые в составе лечебно-профилактических препаратов, должны иметь литический цикл развития (т.е. быть вирулентными), вследствие которого происходит гибель бактериальной клетки-мишени. По определенным участкам генов, кодирующим белок капсида бактериофага, можно быстро и с известной долей вероятности определить его принадлежность к семействам литических фагов.
В 1920–1940 гг. в Канаде и США бактериофаги широко использовались для лечения дизентерии, брюшного тифа и сальмонеллеза. Причем большинство исследователей показали их хорошую клиническую эффективность, в первую очередь снижение смертности на 30% и более по сравнению с группой сравнения [18].
Промышленное производство «кишечных» бактериофагов и их широкое использование в СССР были развернуты в 1940-е годы. Учитывая социально-экономические реалии того времени, большинство исследований посвящалось профилактике и лечению дизентерии. Следует отметить, что эффективность бактериофагов при ОКИ с давних пор изучалась и в ФГБУ НИИДИ ФМБА России. Изучение культур, выделенных от дизентерийных больных в бактериологической лаборатории НИИ детских инфекций под руководством профессора В.Н.Черновой, показало, что в 1968–1973 гг. бактериофагом лизировалось 98–99% выделенных культур шигелл Зонне, что подтверждало целесообразность его применения. Следующим этапом поиска рациональных методов лечения дизентерии явилось исследование эффективности новых форм дизентерийного поливалентного таблетированного бактериофага с ацидорезистентным покрытием и нетиповыми основаниями, синтезированного в Горьковском НИИ эпидемиологии и микробиологии (З.Н.Орлова) в 1969–1972 гг., ранее эффективность применения колипротейного и сальмонеллезного бактериофагов в свечах изучалась Б.М.Элинсон, И.Л.Гусарской (1965 г.).
Результаты лечения детей новыми формами бактериофагов были обобщены в кандидатской диссертации З.Н.Орловой «Эффективность лечения дизентерии у детей новой модификацией бактериофага с ацидорезистентным покрытием в сопоставлении с другими методами по клинико-иммунологическим данным» (1971 г.). Бактериофаги высокоспецифичны при лечении бактериальных инфекций, не вызывают развития резистентности микроорганизмов, являются самовоспроизводящимися организмами: ДНК бактериофага встраивается в хромосому бактерии, вследствие чего бактериальная клетка начинает продуцировать сотни бактериофагов, поражающих бактерии до их полного
уничтожения; бактериофаги в состоянии проникнуть глубоко в очаг инфекции. Они являются не только самовоспроизводящимися организмами, но и саморегулирующимися: когда все бактерии поражены бактериофагами, их количество, как и число бактериофагов, начинает уменьшаться. Бактериофаги оказывают стимулирующее действие на гуморальное и клеточное звенья иммунитета. В отсутствие бактерий, необходимых для размножения бактериофагов, последние быстро удаляются из организма [17, 18, 20, 21].
Традиционной формой выпуска бактериофагов является жидкий препарат (кроме таблетированных форм кишечных фагов), поэтому фаги используют для приема через рот, в виде клизм, аппликаций, орошений, введения в полости ран, вагины, носа, а также путем введения в дренированные полости – брюшную, плевральную, мочевого пузыря, почечной лоханки [18, 20].
Препараты бактериофагов при энтеральном и ректальном пути введения безопасны и нетоксичны для человека. Они не имеют противопоказаний к применению, кроме аллергических реакций, и могут быть использованы в сочетании с любыми другими лекарственными средствами. Препараты бактериофагов можно назначать беременным, кормящим матерям и детям, начиная с раннего возраста [17, 18, 20, 21]; они эффективны в монотерапии, но могут быть также использованы и в комбинации с антибиотиками [22]. Необходимо отметить, что в раннем детском возрасте (до 3–4 мес) использовать бактериофаги можно только по строгим показаниям, учитывая значимую частоту аллергических и диарейных побочных реакций у детей данной возрастной группы. Следует отметить, что побочные реакции в результате употребления фагов обычно связаны с массивным распадом бактериальных клеток с выделением эндотоксина под действием бактериофага. Нивелировать данные нежелательные явления можно при помощи включения в комплекс терапии энтеросорбентов. При использовании фагов в сочетании с терапевтическими дозами АМП отсутствует негативное воздействие
этих препаратов на развитие бактериофагов, но отмечается взаимное потенцирование их терапевтического эффекта. Установлено, что воздействие фагов на антибиотикоустойчивые штаммы бактерий может быть более активным по сравнению с воздействием на антибиотикочувствительные штаммы того же вида [18, 23].
Следовательно, показания к использованию бактериофагов при ОКИ можно сформулировать следующим образом:
• в качестве монотерапии – при стертых и легких формах инвазивных ОКИ;
• в сочетании с антибактериальной терапией или последовательно – при среднетяжелых и тяжелых формах ОКИ в период обратного развития симптомов;
• при бактериовыделении (у реконвалесцентных или транзиторных бактерионосителей);
• в комплексе терапии энтероколитов условно-патогенной и стафилококковой этиологии у детей раннего возраста;
• для коррекции нарушений микробиоценоза кишечника.
Дозы бактериофагов в зависимости от возраста приведены в табл. 1, 2. Бактериофаги назначаются 2–3 раза в сутки. Поскольку при приеме жидких препаратов бактериофагов перорально происходит частичная инактивация бактериофагов кислой средой желудка, целесообразно производить препараты бактериофагов в таблетках с кислотоустойчивыми капсулами и суппозиториях. В табл. 3 представлены бактериофаги, используемые в Российской Федерации для терапии и профилактики инфекционных диарей.
При острых кишечных инфекциях «кишечные» бактериофаги назначают в период разгара болезни (при наличии рвоты, фебрильной лихорадки, выраженного диарейного синдрома) наравне с основной этиотропной терапией [29]. В последние 10–15 лет в РФ большинство публикаций и научных исследований посвящено использованию сальмонеллезного бактериофага при реконвалесцентном бактериовыделении сальмонелл. Наши собственные исследования и исследования других авторов
свидетельствуют о высокой чувствительности циркулирующих штаммов сальмонелл к специфическому бактериофагу (82–96%) [24, 25].
Очень актуальным является исследование В.Г.Акимкина, посвященное купированию продолжительной нозокомиальной вспышки сальмонеллеза в Главном военном клиническом госпитале им. Н.Н.Бурденко, с использованием адаптированного сальмонеллезного бактериофага как в виде монотерапии, так и в комплексе с АМП фторхинолонового ряда [13, 26]. Таким образом, практика использования лечебнопрофилактических бактериофагов показала необходимость осуществления бактериологического мониторинга за возможными изменениями фаголизабильности по отношению к выделяемым культурам сальмонелл в стационаре. Доказано, что регулярная передача на производство свежевыделенных штаммов возбудителей ОКИ способствует повышению литической активности и расширению диапазона действия препаратов бактериофагов [26–28].
Применение бактериофагов по эпидемиологическим показаниям при ОКИ
Бактериофаги находят свое применение и с профилактической целью при чрезвычайных ситуациях природного характера (наводнения и т.д.), в очагах бактериальной инфекции, в первую очередь шигеллеза, сальмонеллеза и брюшного тифа, заболеваний, вызванных условно-патогенными возбудителями (протеем, синегнойной палочкой) [20].
В эпидемических очагах (шигеллеза, сальмонеллеза) бактериофаги применяют для фагирования детей, посещающих детские дошкольные учреждения, и работников пищевых предприятий, водопроводных и коммунальных сооружений и др. Фагирование всех общавшихся с источником ОКИ проводят при неблагоприятных санитарных условиях в очаге, а также при оставлении больного на дому. В качестве профилактики препараты фагов принимают ежедневно в виде разовой возрастной дозы: детям в возрасте от 1 года до 3-х лет – по 1 таблетке; от 3–8 лет – по 2 таблетки; взрослым – по 3 таблетки. Продолжительность приема как правило определяется
условиями эпидситуации.
Если необходимо давать жидкий бактериофаг (шигеллезный, сальмонеллезный или интести-бактериофаг), то пересчет следующий: 1 таблетка сухого бактериофага равна 20 мл жидкого фага. До приема жидкого бактериофага желательно выпить щелочной минеральной воды («Боржоми», «Ессентуки» и т.д.). Противопоказаний к применению бактериофага не имеется. Применение бактериофагов с профилактической целью хорошо зарекомендовало себя во время чрезвычайных ситуаций последних лет: наводнения в Крымске (2012 г.), паводка на Дальнем Востоке (2013 г.).
Наука не стоит на месте: создаются и внедряются новые препараты лечебно-профилактических фагов: разработаны бактериофаги против серраций и энтеробактеров, ведутся работы по созданию фаговых препаратов против Acinetobacter spp. и Helicobacter pylori [17]. Исторически сложилось так, что СССР занимал лидирующие позиции в области производства и применения лечебно-профилактических бактериофагов. Так, на филиалах ФГУП НПО «Микроген» Минздрава России в городах Уфа, Пермь и Нижний Новгород бактериофаги производятся с 1940-х годов. Препараты бактериофагов (производства ФГУП НПО «Микроген») постоянно обогащаются новыми фаговыми
клонами, что позволяет им соответствовать современным циркулирующим штаммам. Препараты бактериофагов являются высокостабильными и могут
храниться в течение длительного периода. Необходимо заметить, что только бактериофаги производства ФГУП НПО «Микроген» являются лекарственными средствами.
Успехи фаготерапии в разных отраслях медицины – это не наследие советской медицины, а доказанные научные явления, нашедшее широкое применение в практическом здравоохранении стран мира. Одним из самых перспективных направлений является изучение возможностей функционирования бактериофагов в биопленках, а следовательно, дальнейшие возможности профилактики и лечения инфекций, связанных с оказанием медицинской помощи.