Что такое бактериальные пирогены
ПИРОГЕННЫЕ ВЕЩЕСТВА
ПИРОГЕННЫЕ ВЕЩЕСТВА (греческий pyr огонь + gennao создавать, производить; синоним пирогены) — биологически активные вещества экзогенного (бактериального и вирусного) и эндогенного (клеточно-тканевого) происхождения, обладающие свойством вызывать перестройку уровня регуляции температурного гомеостаза, приводящую к повышению температуры тела и развитию лихорадки.
Экзогенные Пирогенные вещества не действуют непосредственно на центры терморегуляции; их пирогенная активность опосредуется через образование вторичных, эндогенных, Пирогенных веществ в организме. Такой способностью обладают также метаболиты стероидных гормонов, синтетические хемотоксические пептиды и интерфероногенная двуспиральная РНК. Наиболее высокой биологической активностью обладают липополисахариды грамотрицательных бактерий, способные повышать температуру тела, стимулировать гипофиз-адреналовую систему, лейкоцитопоэз, синтез иммуноглобулинов, образование и выделение лейкоцитами вторичных Пирогенных веществ, интерферона, простагландинов, тормозить рубцово-спаечные процессы и др. К экзогенным П. в. относится препарат пирогенал (см.), который широко применяется для лечения хронических воспалительных заболеваний, как неспецифическое средство для лечения сифилиса; стимуляции регенераторных процессов. Разработаны и другие способы пирогенотерапии (см. Пиротерапия).
Эндогенные П. в. образуются в организме при действии бактериальных П. в. и экзогенных факторов, вызывающих воспаление, а также при иммунопатологических процессах с участием лимфокинов (см. Лихорадка). Основным источником эндогенных П. в. являются моноциты крови, альвеолярные и перитонеальные макрофаги, фиксированные макрофаги селезенки и печени, а также нейтрофильные гранулоциты и эозинофилы; они спонтанно синтезируются клетками некоторых опухолей. Образование эндогенных П. в. лейкоцитами осуществляется только в условиях патологии при взаимодействии с различными раздражителями и протекает в две фазы: фаза активации и фаза освобождения пирогена. Вырабатываемый лейкоцитами П. в. (лейкоцитарный пироген) термолабильный белок с мол. весом (массой) 10 000 — 45 000 обладает в очищенном виде высокой пирогенной активностью; стимулирует лейкоцитопоэз, синтез иммуноглобулинов и белков (фибриногена, гаптоглобина, церулоплазмина, C-реактивного белка). В острой фазе воспаления лейкоцитарный пироген не имеет видовой пирогенной специфичности. Открытие эндогенных П. в. позволило обосновать совр, унитарную теорию лихорадки. Они играют роль белковых медиаторов; их действие на Гипоталамические центры терморегуляции через простагландины и циклические нуклеотиды приводит к смещению уровня регуляции температуры, включению аппарата физической и химической^ терморегуляции, к развитию лихорадки.
Фармакологические препараты, повышающие температуру тела за счет избирательного действия на отдельные звенья аппарата терморегуляции или энергетический обмен (2-4-альфа-динитрофенол, кофеин, лизергиновая к-та и др.), к П. в. не относятся.
Библиография: Веселкин П. Н. Лихорадка, М., 1963; Джексенбаев О. Ш. и Селезнева В. П. Лейкоцитарные пирогены, Журн, микр., эпид, и иммун., № И, с. 50, 1977; Рыбакина Е. Г. и Сорокин А. В. Изучение механизмов активации лейкоцитов в процессе образования лейкоцитарного пирогена, Бюлл. Эксперим, биол, и мед., т. 86, №8, с. 203, 1978;
Cebulа Т. А. а. о. Synthesis of four endogenous pyrogens by rabbit macrophages, J. Lab. clin. Med., v. 94, p. 95, 1979; Dinarellо С. A. Production of endogenous pyrogen, Fed. Proc., v. 38, p. 52, 1979; Kampschmidt R. F. Leueocytic endogenous mediator, J. reticuloendoth. Soc., v. 23, p. 287, 1978; Pyrogens and fever, ed. by G. E. W. Wolstenholme a. J. Birch, p. 81, Edinburgh — L., 1971.
Что такое бактериальные пирогены
Понятие лихорадки. Этиология и патогенез
При данном патологическом процессе сохраняется нормальное функционирование системы терморегуляции, однако происходит ее функциональная перестройка в связи со сдвигом термоустановочной точки центра теплорегуляции.
Однако самостоятельно первичные пирогены не способны вызвать переключение механизмов теплообмена, характерное для лихорадочного состояния. Основным патогенетическим фактором, вне зависимости от причины, является образование эндопирогенов, к которым относятся провоспалительные цитокины (IL-1, IL-6, фактор некроза опухолей), интерферон, гранулоцитарно-моноцитарный колониестимулирующий фактор и др. Источником вторичных пирогенов являются фагоциты, эндотелиоциты, клетки микроглии, а также лимфоциты. Продукция эндопирогенов начинается после взаимодействия вышеупомянутых клеток с первичными пирогенными веществами.
Стадия повышения температуры характеризуется преобладанием теплопродукции над теплоотдачей. Усиливаются окислительные процессы в тканях организма (несократительный термогенез), а также повышается тонус мускулатуры, появляется дрожь (сократительный термогенез). Спазм периферических сосудов приводит к снижению отдачи тепла. Недостаток кровоснабжения обуславливает угнетение функций потовых желез, снижается потоотделение. Человек ощущает озноб.
Существует три варианта изменения терморегуляции:
Однако каков бы ни был механизм изменения терморегуляции, температура увеличивается до тех пор, пока не достигнет уровня, на который сместилась термоустановочная точка.
Система терморегуляции активна и стремится сохранить температурный гомеостаз.
Стадия сохранения высокой температуры: устанавливается баланс между теплопродукцией и теплоотдачей, но на более высоком уровне, чем в норме. Больной чувствует жар (из-за расширения сосудов кожи), у него учащается дыхание, усиливается потоотделение. Термогенез уменьшается за счет снижения интенсивности обмена веществ.
Стадия снижения температуры начинается, когда прекращается образование вторичных пирогенных веществ. Термоустановочная точка возвращается к нормальному уровню, высокая температура тела воспринимается как чрезмерная. Теплоотдача преобладает над теплообразованием, температура тела уменьшается.
Снижение температуры тела может быть:
Метаболизм, функционирование органов и систем при лихорадке
Изменения со стороны обмена веществ. При лихорадке активизируются симпато-адреналовая и гипофизарно-гипоталамо-надпочечниковая системы. За счет этого усиливается основной обмен. Происходит активация окислительных процессов, и, следовательно, возрастает потребность в кислороде (усиливается вентиляция легких, развивается гипокапния).
Перестройка со стороны углеводного и жирового обмена связаны с активацией симпатической нервной системы: усиливается липолиз, повышается распад гликогена в печени (сопровождается повышением концентрации глюкозы в крови). Помимо этого, для лихорадки характерны незавершенность окисления жирных кислот и повышение образования кетоновых тел.
Изменение белкового обмена проявляется усиленным распадом белков и, как следствие, отрицательным азотистым балансом (на это влияет и сокращение поступления белка с пищей из-за снижения аппетита).
Водно-солевой обмен изменяется в зависимости от стадии лихорадки:
Работа органов и систем при лихорадке. Активация симпатико-адреналовой системы влечет за собой изменение функционирования различных органов и систем. Со стороны сердечно-сосудистой системы регистрируется учащение сердечных сокращений, увеличение МОК, повышение артериального давления. На третьей стадии сердечная деятельность восстанавливается, за исключением ситуации резкого падения температуры, когда происходит чрезмерное снижение артериального давления.
Изменения дыхательной системы характеризуются повышением частоты дыхания, увеличением вентиляции легких и активацией газообмена.
Существенно меняется деятельность ЖКТ: снижается слюноотделение (вследствие чего возникает сухость во рту, больной чувствует жажду, у него пропадает аппетит), угнетается выработка пищеварительных соков и перистальтика (усиление процессов брожения и гниения). Все это приводит к значительному нарушению пищеварения [3].
Биологическая роль лихорадки
Негативное воздействие (при сильном и долгосрочном повышении температуры тела):
Лихорадка в стоматологии
Прежде всего стоит обратить внимание на хирургическую стоматологию и челюстно-лицевую хирургию. Лихорадка может сопровождать операции удаления зубов, когда происходит инфицирование лунок [5].
При абсцессах и флегмонах существует риск развития гнойно-резорбтивной лихорадки: происходит расплавление тканей за счет протеолитических ферментов гноя, токсические продукты распада всасываются в кровь и лимфу. Степень тяжести гнойно-резорбтивной лихорадки зависит от распространенности и нагноительного процесса. При устранении гнойного очага, лихорадочное состояние проходит [1].
У детей лихорадка является одним из характерных симптомов прорезывания зубов [2]. Кроме того, лихорадочные состояния возникают при пародонтите, герпетических поражениях ротовой полости, гингивите и других заболеваниях, вызванных бактериями, вирусами и грибками.
Публикации в СМИ
«Нетипичный» актиномикоз – микробиологические аспекты и клинические проявления
Одним их таких «двойных» агентов нормобиоты человека являются актиномицеты.
Они широко распространены в окружающей среде: в почве, воде, в том числе в водопроводной и ключевой, в горячих минеральных источниках, на растениях, на каменистых породах и даже в пустынях. В организме человека актиномицеты сапрофитируют на коже, в ротовой полости, зубном налете, лакунах миндалин, верхних дыхательных путях, бронхах, на слизистой оболочке желудочно-кишечного тракта, влагалища, анальных складок и т. д.
Термин актиномицеты (устаревшее название лучистые грибки) распространяется в настоящее время на широкий круг грамположительных аэробных и микроаэрофильных бактерий, обладающих способностью к формированию ветвящегося мицелия с характерным спороношением, атакже палочек неправильной формы и кокковидных элементов, которые образуются в результате фрагментации мицелия.
К актиномицетам относятся бактерии родов Actinomyces, Actinomadura, Bifidobacterium, Nocardia, Micromonospora, Rhodococcus, Streptomyces, Tsukamurella и др.
Переходу актиномицетов из сапрофитического в паразитическое состояние способствуют снижение иммунозащитных сил организма, наличие тяжелых инфекционных или соматических заболеваний (хронической пневмонии, гнойного гидраденита, диабета и т. д.), воспалительные заболевания слизистых оболочек полости рта, респираторного и желудочно-кишечного тракта, оперативные вмешательства, длительное применение внутриматочных контрацептивов, переохлаждение, травмы и др.
В таких случаях развивается актиномикоз — хроническое гнойное неконтагиозное заболевание, обусловленное формированием характерных синюшно-красных, а затем багровых инфильтратов плотной консистенции с множественными очагами флюктуации и свищами с гнойным отделяемым в мягких и костных тканях практически любых локализаций. Длительность инкубационного периода может колебаться от 2–3 недель до нескольких лет (от времени инфицирования до развития манифестных форм актиномикоза).
Ведущим в развитии актиномикоза является эндогенный способ, при котором возбудитель проникает в ткани из мест его сапрофитического обитания, чаще всего через пищеварительный тракт и полость рта (кариозные зубы, десневые карманы, крипты миндалин). Наиболее благоприятные условия для внедрения актиномицетов создаются в толстой кишке, вследствие застоя пищевых масс и большей вероятности травматизации стенки. При экзогенном способе возбудители проникают в организм из окружающей среды аэрогенно или при травматических повреждениях кожи и слизистых оболочек.
Распространение актиномицетов из первичного очага поражения происходит контактным путем по подкожной клетчатке и соединительнотканным прослойкам органов и тканей. Возможен также и гематогенный путь при прорыве актиномикотической гранулемы в кровеносный сосуд.
Основными возбудителями актиномикоза являются Actinomyces israelii, A. bovis, Streptomyces albus, Micromonospora monospora; нокардиоза («атипичного актиномикоза») и мицетомы — Nocardia asteroides, N. brasiliensis. Список выявляемых патогенных актиномицетов расширяется. В современной литературе все чаще описываются случаи актиномикоза, вызванного редкими видами: Actinomyces viscosus, A. graevenitzii, A. turicensis, A. radingae, A. meyeri, A. gerencseriae, Propionibacterium propionicum и др.
В возникновении и формировании актиномикотического процесса также существенную роль играют сопутствующие аэробные и анаэробные бактерии. Большинство случаев актиномикоза обусловлены полимикробной флорой. Обычно наряду с актиномицетами выделяют Staphylococcus spp., Streptococcus spp., Fusobacterium spp., Capnocytophaga spp., Bacteroides spp., представителей семейства Enterobacteriaceae и др. Присоединение гноеродных микроорганизмов обостряет течение актиномикоза, изменяет его клиническую картину, способствует распространению процесса.
Клиническая картина актиномикоза разнообразна, встречается во всех странах в практике врачей различных специальностей (стоматологов, хирургов, дерматологов, гинекологов и др.). Основные локализации — челюстно-лицевая (до 80%), торакальная, абдоминальная, параректальная, мицетома (мадурская стопа). Кроме того, актиномикотические поражения проявляются не только в классическом виде с характерной инфильтрацией тканей, абсцессами и свищами, но и в виде доминирующей патогенной флоры неспецифического воспалительного процесса, осложняющего течение основного заболевания.
Актиномицеты могут играть активную роль в этиологии хронического тонзиллита. Небные миндалины колонизируются актиномицетами при хроническом тонзиллите и в ассоциации с другими бактериями часто провоцируют воспалительные реакции. Вследствие стоматологических процедур может возникнуть актиномикотическая бактеримия полости рта. В 30% случаев от 80% выявленных бактеримий определяется актиномикотическая природа стоматита, этиологическими агентами которого являются сапрофиты ротовой полости — A. viscosus, A. odontolyticus и A. naeslundi. Присоединяясь к местной патогенной флоре, актиномицеты способствуют развитию длительно незаживающего воспалительного процесса при угревой сыпи, трофических язвах, гиперемиях, мацерациях и мокнутиях на коже. Обладая высокой степенью колонизации кишечника, они являются одним из основных агентов дисбактериоза. Обобщая все вышеизложенное, нужно отметить, что бактерии из обширной группы актиномицетов могут фигурировать как участники любых инфекционных и воспалительных проявлений организма человека от дерматита до эндокардита.
Таким образом, актиномикоз, отличающийся многообразием локализаций и клинических проявлений, нужно своевременно диагностировать и возможно эффективно лечить, зная закономерности патогенетического развития, предрасполагающих факторов инфицирования, характеристик возбудителей и методов лечения.
Однако диагностика и лечение заболеваний, связанных с участием актиномицетов, являются предметами единичных специализированных лабораторий и клиник в мире. Трудности в их дифференциальной диагностике служат препятствием широкой известности этих микроорганизмов в клинической практике.
Диагностика актиномикоза
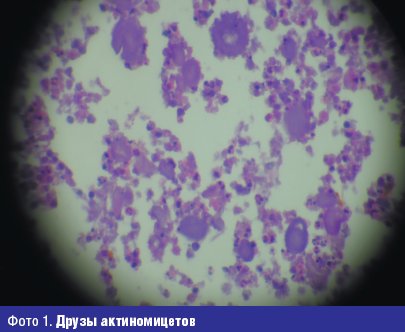
Достоверным признаком актиномикоза является обнаружение характерных актиномикотических друз в виде маленьких желтоватых зерен, напоминающих крупинки песка, в гное из свищей, в биоптатах пораженных тканей. В нативном (не окрашенном) и гистологических препаратах друзы хорошо видны на фоне гнойного детрита в виде лучистых образований с более плотным гомогенно-зернистым центром из тонкого, густо переплетенного мицелия (фото 1). За способность образовывать радиально расположенные нити мицелия, часто с «колбочками» на концах, актиномицеты и были названы в свое время «лучистыми грибами». Ведущее значение в образовании друз — тканевых колоний актиномицетов — имеет ответная реакция макроорганизма на антигены, секретируемые актиномицетами в окружающую среду. Друзообразование способствует замедлению диссеминации возбудителя в пораженном организме, а также локализации патологического процесса. Для актиномикоза характерны специфические тканевые реакции: гранулематозное продуктивное воспаление, лейкоцитарная инфильтрация, микроабсцессы, «ячеистая» структура тканей, специфическая гранулема, окруженная полинуклеарами, гигантскими и плазматическими клетками, лимфоцитами и гистиоцитами.
В организме больных друзы развиваются не на всех этапах заболевания и свойственны не каждой разновидности «лучистого гриба», поэтому их находят не всегда, и отсутствие друз на начальных этапах диагностики не отрицает актиномикоз. Кроме того, эти образования способны спонтанно лизироваться, обызвествляться, деформироваться, кальцинироваться и подвергаться другим дегенеративным изменениям.
Друзы не образуются при нокардиозе. В тканях Nocardia обнаруживается в виде тонких нитей мицелия 0,5–0,8 мкм и палочковидных форм такой же толщины. Благодаря своей кислотоустойчивости Nocardia хорошо окрашивается по Граму–Вейгерту в синий цвет и по Цилю–Нильсену — в красный: все это позволяет проводить дифференциальную диагностику между актиномикозом и нокардиозом, т. к. это диктуется различием методов лечения при этих болезнях.
Важное значение для верификации актиномикоза любых локализаций имеет микробиологическое исследование, которое включает микроскопию и посев патологического материала на питательные среды. Оптимальная температура для роста 35–37°С.
При микроскопии клинического материала и выросших культур, окрашенных по Граму или метиленовой синькой, актиномицеты выглядят как ветвистые нити длиной 10–50 мкм или представлены полиморфными короткими палочками 0,2–1,0×2–5 мкм, часто с булавовидными концами, одиночные, в парах V- и Y-образной конфигураций и в стопках. Грамположительные, но часто окрашивание не типичное, в виде четок.
Многие аэробные актиномицеты хорошо растут на обычных бактериологических средах — мясо-пептонном, триптиказо-соевом, кровяном и сердечно-мозговом агарах. Для выявления микроаэрофильных видов используют тиогликолевую среду. Культуральные признаки актиномицетов весьма разнообразны. На плотных агаровых средах колонии по размерам напоминают бактериальные — диаметром 0,3–0,5 мм. Поверхность колоний может быть плоской, гладкой, бугристой, складчатой, зернистой или мучнистой. Консистенция тестовидная, крошковатая или кожистая. Многие актиномицеты образуют пигменты, придающие колониям самые различные оттенки: сероватые, синеватые, оранжевые, малиновые, зеленоватые, коричневые, черновато-фиолетовые и др.
Клинические аэробные изоляты, например Nocardia asteroids и Streptomyces somaliensis, на богатой питательной среде дают так называемый атипичный рост — плотные кожистые колонии, обычно не опушенные столь типичным для штаммов воздушным мицелием и без спороношения. Для проявления дифференцировки, образования характерных спор и пигментов требуются специальные среды: с коллоидным хитином, почвенным экстрактом или отварами растительных материалов.
В жидкой питательной среде чистые культуры микроаэрофильных актиномицетов образуют взвешенные в субстрате беловатые «комочки». Среда остается прозрачной. При бактериальных примесях — среда мутная, гомогенная.
Описание клинических случаев «нетипичного» актиномикоза
За период 2007 года под нашим наблюдением находилось 25 больных с различными клиническими формами актиномикоза. Среди обследованных пациентов было 12 женщин и 13 мужчин (в возрасте 15–25 лет — 4 человека, 26–35 лет — 4 человека, 36–45 — 2, 46–55 — 5 человек и 56–66 лет — 10 человек).
Помимо «классического» актиномикоза челюстно-лицевой, подмышечной и паховой областей в свищевой стадии нами были диагностированы актиномикотические осложнения различных патологических процессов. Так, например, актиномицеты обнаруживались в вагинальном отделяемом у больной с неспецифическим кольпитом и вульвовагинитом, что серьезно утяжеляло течение основного заболевания, требовало проведения неоднократного курса противовоспалительной терапии. Актиномицеты в диагностически значимом количестве были выявлены при воспалительных процессах в полости рта (в соскобах с зева, миндалин, языка), при отомикозе, при длительно незаживающих мацерациях и гиперемии кожи в перианальной области, со слизистых оболочек ампулы прямой кишки. Присоединение актиномицетов к гноеродной микробиоте трофических язв значительно утяжеляло течение заболевания, осложняло процесс лечения таких больных, замедляя регрессию очагов поражения. У пациентов с угревой болезнью при вскрытии очагов воспаления в себуме нередко обнаруживались актиномицеты, присутствие которых способствовало развитию затяжного течения заболевания.
Под нашим наблюдением находилась больная К., 43 лет с редким случаем первичного актиномикоза кожи мягких тканей паховых областей, свищевая форма.
Больна в течение 1 года, когда появились изменения в паховой области слева вследствие постоянного натирания кожи неудобным нижним бельем. К врачам не обращалась. Ухудшение в декабре 2007 г., когда появились 2 язвы, свищи с гнойным отделяемым. Консультирована дерматологом, который заподозрил неопластический процесс. Обследована онкологом, паразитологом. Диагноз онкологического или паразитарного заболевания установить не удалось. Направлена к микологу с подозрением на глубокий микоз. При осмотре: очаг поражения расположен в левой паховой области размером около 1,7×5 см, функционируют 2 свища со скудным гнойным и сукровичным отделяемым. Больная обследована в микологической лаборатории института им. Е. И. Марциновского ММА им. И. М. Сеченова на актиномикоз и бактериальную инфекцию. В исследуемом патологическом материале при микроскопии препаратов обнаружены актиномицеты, палочки, кокки, лептотрихии. При посеве гнойного отделяемого из свищей на питательные среды получен рост актиномицетов и кокковой флоры.
Диагноз актиномикоза кожи и мягких тканей верифицирован. Больная проходит наблюдение и лечение у миколога.
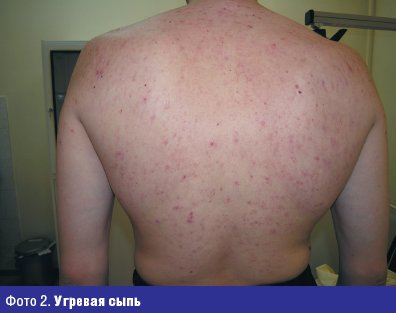
Больной Н., 24 лет с диагнозом угревая болезнь, актиномикоз (фото 2).
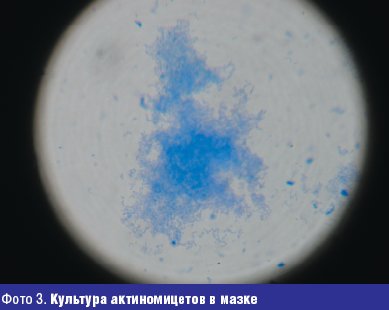
Жалобы на высыпания на коже туловища с детства. Достоверно можно говорить о давности заболевания 10 лет, когда в 14-летнем возрасте был установлен диагноз угревая болезнь. Больной лечился наружными средствами и антибиотиками различных групп с временным эффектом. Общее состояние в настоящее время осложнилось хроническим гастритом. При осмотре: кожа туловища, лица, спины поражены воспалительными элементами (папуло-пустулезная сыпь, открытые и закрытые комедоны), в некоторых местах сливного характера, инфильтрация кожи и мягких тканей. При микроскопическом исследовании себума из элементов угревой сыпи у больного обнаружены кокки и единичные палочки. В посеве из исследуемого материала в условиях микологической лаборатории (фото 3).
Диагноз: угревая болезнь, актиномикоз лица, туловища, спины кожи и мягких тканей вторичного характера, инфильтративная форма в стадии умеренно выраженного обострения. В настоящее время больному проводится лечение микологом в поликлинике института им. Е. И. Марциновского ММА им. И. М. Сеченова.
Лечение
Лечение больных актиномикозом проводится комплексное в различных сочетаниях в зависимости от локализации и клинических проявлений — препаратами йода, антибиотиками, иммунокоррегирующими и общеукрепляющими средствами, актинолизатом, проводят местное лечение мазями, физиотерапевтическими процедурами и хирургическим вмешательством.
Йодистые препараты (до 3 г йодистого калия в день), ранее доминирующие в терапии актиномикоза, в настоящее время могут применяться в комбинации с антибиотиками или рентгенотерапией, как дополнительное средство для размягчения и рассасывания инфильтрата.
Ведущее место в лечении актиномикоза занимают антибиотики. Наиболее часто используются антибактериальные препараты из группы тетрациклинов, пенициллинов, карбопенемов, линкозаминов, аминогликозидов, цефалоспоринов, действующими веществами которых являются гентамицин, амикацин, тобрамицин, линкомицин, левофлоксацин, цефаклор, цефалексин. Хорошо себя зарекомендовали препараты «Панклав», «Флемоксин Солютаб», «Юнидокс Солютаб» и др. Необходим длительный курс антимикробной терапии (от 6 месяцев до 1 года) и высокие дозы препаратов. Традиционная терапия актиномикоза включает внутривенное введение пенициллина в дозе 18–24 миллионов ЕД ежедневно в течение 2–6 недель, с последующим пероральным приемом пенициллина, амоксициллина или ампициллина в течение 6–12 месяцев. В более легких случаях, в частности при шейно-челюстно-лицевом актиномикозе, достаточно менее интенсивного лечения короткими курсами антибактериальной терапии. Имеется опыт эффективного краткосрочного лечения актиномикоза имипенемом в течение 6–10 недель и цефтриаксоном ежедневно в течение 3 недель. Антимикробную терапию продолжают некоторое время после исчезновения симптоматики для предотвращения рецидива.
При лечении актиномикоза также необходимо учитывать присоединяющуюся патогенную микрофлору, которая может проявлять повышенную резистентность к антибиотикам, что объясняется длительным предшествующим применением различных химиопрепаратов. С целью воздействия на сопутствующую флору используют метронидазол (Метрогил, Трихопол, Эфлоран) и клиндамицин (Далацин, Климицин). Хороший противовоспалительный эффект показывает применение сульфаниламидных препаратов (ко-тримоксазол, сульфадиметоксин, сульфакарбамид). При присоединении микотической инфекции назначают противогрибковые препараты: флуконазол, итраконазол, тербинафин, кетоконазол и др.
Иммунокоррегирующие средства. Для коррекции иммунодефицита показан Диуцифон внутрь — по 0,1 г 3 раза в день или внутримышечно в виде 5%-го раствора по 5 мл через день в течение 3–4 недель. По нашему мнению, также хорошо зарекомендовал себя иммунокоррегирующий препарат «Циклоферон» — 2 мл внутримышечно через день, 10 дней.
Общеукрепляющая терапия стимулирует реактивность организма и повышает эффективность иммунотерапии. Дезинтоксикационная терапия проводится внутривенными растворами Гемодеза, 5% раствором глюкозы и др. С целью активации регенерации применяется аутогемотерапия — еженедельно, всего на курс 3–4 переливания. Витамины назначают в среднетерапевтических дозах.
Иммунотерапия Актинолизатом способствует накоплению специфических иммунных тел и улучшает результаты лечения, позволяя снизить объем антибактериальных средств и избежать нежелательных побочных воздействий. Актинолизат вводят внутримышечно 2 раза в неделю по 3 мл, на курс 25 инъекций, курсы повторяют 2–3 раза с интервалом в 1 месяц.
В качестве местной терапии показано мазевое лечение с антибактериальными препаратами указанных групп, промывание свищей растворами антисептиков, препаратами фуранового типа, введение 1%, 2%, 5% спиртового раствора йода, которые способствуют очищению актиномикозных очагов и ликвидации воспалительных явлений.
Физиотерапевтические процедуры. В стадии формирования очага проводят электрофорез кальция хлорида и Димедрола. После вскрытия очагов при остаточных инфильтратах назначают электрофорез йода, Лидазы, флюкторизацию. Ультразвук применяется непосредственно на область очага поражения по общепринятой схеме в течение 12–25 дней (в зависимости от состояния больного и очага поражения) с интервалами в 3–4 месяца.
Хирургическое лечение проводится на фоне консервативной терапии и заключается в радикальном иссечении очагов поражения в пределах видимо здоровых тканей. При невозможности проведения радикальной операции (например, при шейно-челюстно-лицевом актиномикозе) показано вскрытие и дренирование очагов абсцесса.
Код вставки на сайт
«Нетипичный» актиномикоз – микробиологические аспекты и клинические проявления
Одним их таких «двойных» агентов нормобиоты человека являются актиномицеты.
Они широко распространены в окружающей среде: в почве, воде, в том числе в водопроводной и ключевой, в горячих минеральных источниках, на растениях, на каменистых породах и даже в пустынях. В организме человека актиномицеты сапрофитируют на коже, в ротовой полости, зубном налете, лакунах миндалин, верхних дыхательных путях, бронхах, на слизистой оболочке желудочно-кишечного тракта, влагалища, анальных складок и т. д.
Термин актиномицеты (устаревшее название лучистые грибки) распространяется в настоящее время на широкий круг грамположительных аэробных и микроаэрофильных бактерий, обладающих способностью к формированию ветвящегося мицелия с характерным спороношением, атакже палочек неправильной формы и кокковидных элементов, которые образуются в результате фрагментации мицелия.
К актиномицетам относятся бактерии родов Actinomyces, Actinomadura, Bifidobacterium, Nocardia, Micromonospora, Rhodococcus, Streptomyces, Tsukamurella и др.
Переходу актиномицетов из сапрофитического в паразитическое состояние способствуют снижение иммунозащитных сил организма, наличие тяжелых инфекционных или соматических заболеваний (хронической пневмонии, гнойного гидраденита, диабета и т. д.), воспалительные заболевания слизистых оболочек полости рта, респираторного и желудочно-кишечного тракта, оперативные вмешательства, длительное применение внутриматочных контрацептивов, переохлаждение, травмы и др.
В таких случаях развивается актиномикоз — хроническое гнойное неконтагиозное заболевание, обусловленное формированием характерных синюшно-красных, а затем багровых инфильтратов плотной консистенции с множественными очагами флюктуации и свищами с гнойным отделяемым в мягких и костных тканях практически любых локализаций. Длительность инкубационного периода может колебаться от 2–3 недель до нескольких лет (от времени инфицирования до развития манифестных форм актиномикоза).
Ведущим в развитии актиномикоза является эндогенный способ, при котором возбудитель проникает в ткани из мест его сапрофитического обитания, чаще всего через пищеварительный тракт и полость рта (кариозные зубы, десневые карманы, крипты миндалин). Наиболее благоприятные условия для внедрения актиномицетов создаются в толстой кишке, вследствие застоя пищевых масс и большей вероятности травматизации стенки. При экзогенном способе возбудители проникают в организм из окружающей среды аэрогенно или при травматических повреждениях кожи и слизистых оболочек.
Распространение актиномицетов из первичного очага поражения происходит контактным путем по подкожной клетчатке и соединительнотканным прослойкам органов и тканей. Возможен также и гематогенный путь при прорыве актиномикотической гранулемы в кровеносный сосуд.
Основными возбудителями актиномикоза являются Actinomyces israelii, A. bovis, Streptomyces albus, Micromonospora monospora; нокардиоза («атипичного актиномикоза») и мицетомы — Nocardia asteroides, N. brasiliensis. Список выявляемых патогенных актиномицетов расширяется. В современной литературе все чаще описываются случаи актиномикоза, вызванного редкими видами: Actinomyces viscosus, A. graevenitzii, A. turicensis, A. radingae, A. meyeri, A. gerencseriae, Propionibacterium propionicum и др.
В возникновении и формировании актиномикотического процесса также существенную роль играют сопутствующие аэробные и анаэробные бактерии. Большинство случаев актиномикоза обусловлены полимикробной флорой. Обычно наряду с актиномицетами выделяют Staphylococcus spp., Streptococcus spp., Fusobacterium spp., Capnocytophaga spp., Bacteroides spp., представителей семейства Enterobacteriaceae и др. Присоединение гноеродных микроорганизмов обостряет течение актиномикоза, изменяет его клиническую картину, способствует распространению процесса.
Клиническая картина актиномикоза разнообразна, встречается во всех странах в практике врачей различных специальностей (стоматологов, хирургов, дерматологов, гинекологов и др.). Основные локализации — челюстно-лицевая (до 80%), торакальная, абдоминальная, параректальная, мицетома (мадурская стопа). Кроме того, актиномикотические поражения проявляются не только в классическом виде с характерной инфильтрацией тканей, абсцессами и свищами, но и в виде доминирующей патогенной флоры неспецифического воспалительного процесса, осложняющего течение основного заболевания.
Актиномицеты могут играть активную роль в этиологии хронического тонзиллита. Небные миндалины колонизируются актиномицетами при хроническом тонзиллите и в ассоциации с другими бактериями часто провоцируют воспалительные реакции. Вследствие стоматологических процедур может возникнуть актиномикотическая бактеримия полости рта. В 30% случаев от 80% выявленных бактеримий определяется актиномикотическая природа стоматита, этиологическими агентами которого являются сапрофиты ротовой полости — A. viscosus, A. odontolyticus и A. naeslundi. Присоединяясь к местной патогенной флоре, актиномицеты способствуют развитию длительно незаживающего воспалительного процесса при угревой сыпи, трофических язвах, гиперемиях, мацерациях и мокнутиях на коже. Обладая высокой степенью колонизации кишечника, они являются одним из основных агентов дисбактериоза. Обобщая все вышеизложенное, нужно отметить, что бактерии из обширной группы актиномицетов могут фигурировать как участники любых инфекционных и воспалительных проявлений организма человека от дерматита до эндокардита.
Таким образом, актиномикоз, отличающийся многообразием локализаций и клинических проявлений, нужно своевременно диагностировать и возможно эффективно лечить, зная закономерности патогенетического развития, предрасполагающих факторов инфицирования, характеристик возбудителей и методов лечения.
Однако диагностика и лечение заболеваний, связанных с участием актиномицетов, являются предметами единичных специализированных лабораторий и клиник в мире. Трудности в их дифференциальной диагностике служат препятствием широкой известности этих микроорганизмов в клинической практике.
Диагностика актиномикоза
Достоверным признаком актиномикоза является обнаружение характерных актиномикотических друз в виде маленьких желтоватых зерен, напоминающих крупинки песка, в гное из свищей, в биоптатах пораженных тканей. В нативном (не окрашенном) и гистологических препаратах друзы хорошо видны на фоне гнойного детрита в виде лучистых образований с более плотным гомогенно-зернистым центром из тонкого, густо переплетенного мицелия (фото 1). За способность образовывать радиально расположенные нити мицелия, часто с «колбочками» на концах, актиномицеты и были названы в свое время «лучистыми грибами». Ведущее значение в образовании друз — тканевых колоний актиномицетов — имеет ответная реакция макроорганизма на антигены, секретируемые актиномицетами в окружающую среду. Друзообразование способствует замедлению диссеминации возбудителя в пораженном организме, а также локализации патологического процесса. Для актиномикоза характерны специфические тканевые реакции: гранулематозное продуктивное воспаление, лейкоцитарная инфильтрация, микроабсцессы, «ячеистая» структура тканей, специфическая гранулема, окруженная полинуклеарами, гигантскими и плазматическими клетками, лимфоцитами и гистиоцитами.
В организме больных друзы развиваются не на всех этапах заболевания и свойственны не каждой разновидности «лучистого гриба», поэтому их находят не всегда, и отсутствие друз на начальных этапах диагностики не отрицает актиномикоз. Кроме того, эти образования способны спонтанно лизироваться, обызвествляться, деформироваться, кальцинироваться и подвергаться другим дегенеративным изменениям.
Друзы не образуются при нокардиозе. В тканях Nocardia обнаруживается в виде тонких нитей мицелия 0,5–0,8 мкм и палочковидных форм такой же толщины. Благодаря своей кислотоустойчивости Nocardia хорошо окрашивается по Граму–Вейгерту в синий цвет и по Цилю–Нильсену — в красный: все это позволяет проводить дифференциальную диагностику между актиномикозом и нокардиозом, т. к. это диктуется различием методов лечения при этих болезнях.
Важное значение для верификации актиномикоза любых локализаций имеет микробиологическое исследование, которое включает микроскопию и посев патологического материала на питательные среды. Оптимальная температура для роста 35–37°С.
При микроскопии клинического материала и выросших культур, окрашенных по Граму или метиленовой синькой, актиномицеты выглядят как ветвистые нити длиной 10–50 мкм или представлены полиморфными короткими палочками 0,2–1,0×2–5 мкм, часто с булавовидными концами, одиночные, в парах V- и Y-образной конфигураций и в стопках. Грамположительные, но часто окрашивание не типичное, в виде четок.
Многие аэробные актиномицеты хорошо растут на обычных бактериологических средах — мясо-пептонном, триптиказо-соевом, кровяном и сердечно-мозговом агарах. Для выявления микроаэрофильных видов используют тиогликолевую среду. Культуральные признаки актиномицетов весьма разнообразны. На плотных агаровых средах колонии по размерам напоминают бактериальные — диаметром 0,3–0,5 мм. Поверхность колоний может быть плоской, гладкой, бугристой, складчатой, зернистой или мучнистой. Консистенция тестовидная, крошковатая или кожистая. Многие актиномицеты образуют пигменты, придающие колониям самые различные оттенки: сероватые, синеватые, оранжевые, малиновые, зеленоватые, коричневые, черновато-фиолетовые и др.
Клинические аэробные изоляты, например Nocardia asteroids и Streptomyces somaliensis, на богатой питательной среде дают так называемый атипичный рост — плотные кожистые колонии, обычно не опушенные столь типичным для штаммов воздушным мицелием и без спороношения. Для проявления дифференцировки, образования характерных спор и пигментов требуются специальные среды: с коллоидным хитином, почвенным экстрактом или отварами растительных материалов.
В жидкой питательной среде чистые культуры микроаэрофильных актиномицетов образуют взвешенные в субстрате беловатые «комочки». Среда остается прозрачной. При бактериальных примесях — среда мутная, гомогенная.
Описание клинических случаев «нетипичного» актиномикоза
За период 2007 года под нашим наблюдением находилось 25 больных с различными клиническими формами актиномикоза. Среди обследованных пациентов было 12 женщин и 13 мужчин (в возрасте 15–25 лет — 4 человека, 26–35 лет — 4 человека, 36–45 — 2, 46–55 — 5 человек и 56–66 лет — 10 человек).
Помимо «классического» актиномикоза челюстно-лицевой, подмышечной и паховой областей в свищевой стадии нами были диагностированы актиномикотические осложнения различных патологических процессов. Так, например, актиномицеты обнаруживались в вагинальном отделяемом у больной с неспецифическим кольпитом и вульвовагинитом, что серьезно утяжеляло течение основного заболевания, требовало проведения неоднократного курса противовоспалительной терапии. Актиномицеты в диагностически значимом количестве были выявлены при воспалительных процессах в полости рта (в соскобах с зева, миндалин, языка), при отомикозе, при длительно незаживающих мацерациях и гиперемии кожи в перианальной области, со слизистых оболочек ампулы прямой кишки. Присоединение актиномицетов к гноеродной микробиоте трофических язв значительно утяжеляло течение заболевания, осложняло процесс лечения таких больных, замедляя регрессию очагов поражения. У пациентов с угревой болезнью при вскрытии очагов воспаления в себуме нередко обнаруживались актиномицеты, присутствие которых способствовало развитию затяжного течения заболевания.
Под нашим наблюдением находилась больная К., 43 лет с редким случаем первичного актиномикоза кожи мягких тканей паховых областей, свищевая форма.
Больна в течение 1 года, когда появились изменения в паховой области слева вследствие постоянного натирания кожи неудобным нижним бельем. К врачам не обращалась. Ухудшение в декабре 2007 г., когда появились 2 язвы, свищи с гнойным отделяемым. Консультирована дерматологом, который заподозрил неопластический процесс. Обследована онкологом, паразитологом. Диагноз онкологического или паразитарного заболевания установить не удалось. Направлена к микологу с подозрением на глубокий микоз. При осмотре: очаг поражения расположен в левой паховой области размером около 1,7×5 см, функционируют 2 свища со скудным гнойным и сукровичным отделяемым. Больная обследована в микологической лаборатории института им. Е. И. Марциновского ММА им. И. М. Сеченова на актиномикоз и бактериальную инфекцию. В исследуемом патологическом материале при микроскопии препаратов обнаружены актиномицеты, палочки, кокки, лептотрихии. При посеве гнойного отделяемого из свищей на питательные среды получен рост актиномицетов и кокковой флоры.
Диагноз актиномикоза кожи и мягких тканей верифицирован. Больная проходит наблюдение и лечение у миколога.
Больной Н., 24 лет с диагнозом угревая болезнь, актиномикоз (фото 2).
Жалобы на высыпания на коже туловища с детства. Достоверно можно говорить о давности заболевания 10 лет, когда в 14-летнем возрасте был установлен диагноз угревая болезнь. Больной лечился наружными средствами и антибиотиками различных групп с временным эффектом. Общее состояние в настоящее время осложнилось хроническим гастритом. При осмотре: кожа туловища, лица, спины поражены воспалительными элементами (папуло-пустулезная сыпь, открытые и закрытые комедоны), в некоторых местах сливного характера, инфильтрация кожи и мягких тканей. При микроскопическом исследовании себума из элементов угревой сыпи у больного обнаружены кокки и единичные палочки. В посеве из исследуемого материала в условиях микологической лаборатории (фото 3).
Диагноз: угревая болезнь, актиномикоз лица, туловища, спины кожи и мягких тканей вторичного характера, инфильтративная форма в стадии умеренно выраженного обострения. В настоящее время больному проводится лечение микологом в поликлинике института им. Е. И. Марциновского ММА им. И. М. Сеченова.
Лечение
Лечение больных актиномикозом проводится комплексное в различных сочетаниях в зависимости от локализации и клинических проявлений — препаратами йода, антибиотиками, иммунокоррегирующими и общеукрепляющими средствами, актинолизатом, проводят местное лечение мазями, физиотерапевтическими процедурами и хирургическим вмешательством.
Йодистые препараты (до 3 г йодистого калия в день), ранее доминирующие в терапии актиномикоза, в настоящее время могут применяться в комбинации с антибиотиками или рентгенотерапией, как дополнительное средство для размягчения и рассасывания инфильтрата.
Ведущее место в лечении актиномикоза занимают антибиотики. Наиболее часто используются антибактериальные препараты из группы тетрациклинов, пенициллинов, карбопенемов, линкозаминов, аминогликозидов, цефалоспоринов, действующими веществами которых являются гентамицин, амикацин, тобрамицин, линкомицин, левофлоксацин, цефаклор, цефалексин. Хорошо себя зарекомендовали препараты «Панклав», «Флемоксин Солютаб», «Юнидокс Солютаб» и др. Необходим длительный курс антимикробной терапии (от 6 месяцев до 1 года) и высокие дозы препаратов. Традиционная терапия актиномикоза включает внутривенное введение пенициллина в дозе 18–24 миллионов ЕД ежедневно в течение 2–6 недель, с последующим пероральным приемом пенициллина, амоксициллина или ампициллина в течение 6–12 месяцев. В более легких случаях, в частности при шейно-челюстно-лицевом актиномикозе, достаточно менее интенсивного лечения короткими курсами антибактериальной терапии. Имеется опыт эффективного краткосрочного лечения актиномикоза имипенемом в течение 6–10 недель и цефтриаксоном ежедневно в течение 3 недель. Антимикробную терапию продолжают некоторое время после исчезновения симптоматики для предотвращения рецидива.
При лечении актиномикоза также необходимо учитывать присоединяющуюся патогенную микрофлору, которая может проявлять повышенную резистентность к антибиотикам, что объясняется длительным предшествующим применением различных химиопрепаратов. С целью воздействия на сопутствующую флору используют метронидазол (Метрогил, Трихопол, Эфлоран) и клиндамицин (Далацин, Климицин). Хороший противовоспалительный эффект показывает применение сульфаниламидных препаратов (ко-тримоксазол, сульфадиметоксин, сульфакарбамид). При присоединении микотической инфекции назначают противогрибковые препараты: флуконазол, итраконазол, тербинафин, кетоконазол и др.
Иммунокоррегирующие средства. Для коррекции иммунодефицита показан Диуцифон внутрь — по 0,1 г 3 раза в день или внутримышечно в виде 5%-го раствора по 5 мл через день в течение 3–4 недель. По нашему мнению, также хорошо зарекомендовал себя иммунокоррегирующий препарат «Циклоферон» — 2 мл внутримышечно через день, 10 дней.
Общеукрепляющая терапия стимулирует реактивность организма и повышает эффективность иммунотерапии. Дезинтоксикационная терапия проводится внутривенными растворами Гемодеза, 5% раствором глюкозы и др. С целью активации регенерации применяется аутогемотерапия — еженедельно, всего на курс 3–4 переливания. Витамины назначают в среднетерапевтических дозах.
Иммунотерапия Актинолизатом способствует накоплению специфических иммунных тел и улучшает результаты лечения, позволяя снизить объем антибактериальных средств и избежать нежелательных побочных воздействий. Актинолизат вводят внутримышечно 2 раза в неделю по 3 мл, на курс 25 инъекций, курсы повторяют 2–3 раза с интервалом в 1 месяц.
В качестве местной терапии показано мазевое лечение с антибактериальными препаратами указанных групп, промывание свищей растворами антисептиков, препаратами фуранового типа, введение 1%, 2%, 5% спиртового раствора йода, которые способствуют очищению актиномикозных очагов и ликвидации воспалительных явлений.
Физиотерапевтические процедуры. В стадии формирования очага проводят электрофорез кальция хлорида и Димедрола. После вскрытия очагов при остаточных инфильтратах назначают электрофорез йода, Лидазы, флюкторизацию. Ультразвук применяется непосредственно на область очага поражения по общепринятой схеме в течение 12–25 дней (в зависимости от состояния больного и очага поражения) с интервалами в 3–4 месяца.
Хирургическое лечение проводится на фоне консервативной терапии и заключается в радикальном иссечении очагов поражения в пределах видимо здоровых тканей. При невозможности проведения радикальной операции (например, при шейно-челюстно-лицевом актиномикозе) показано вскрытие и дренирование очагов абсцесса.