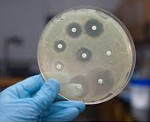
Что способствует распространению нозокомиальных инфекций
Внутрибольничная инфекция, что это и как ее контролировать
Внутрибольничная инфекция, что это и как ее контролировать
24 сентября 2015
Кроме того, инфекция считается внутрибольничной, если она впервые проявляется через 48 часов или более после пребывания в больнице при отсутствии клинических проявлений этих инфекций в момент поступления и исключения вероятности инкубационного периода.
Природа ВБИ сложнее, чем казалась долгие годы. Она определяется не только недостаточностью социально-экономической обеспеченности лечебной сферы, но и часто непредсказуемой эволюцией микроорганизмов.
Ни одна больница мира не может полностью избавиться ВБИ, но такие инфекции можно контролировать и учитывать их особенности.
На уровне ВОЗ существует глобальная стратегия в отношении контроля за развитием антибиотико-резистентности у микроорганизмов и образованием таких штаммов, которые часто вызывают ВБИ.
На уровне МЗ Украины существует ряд методических указаний, утвержденных приказами, устанавливающие современные подходы к определению чувствительности возбудителей инфекционных болезней с учетом рекомендаций Европейского комитета по определению чувствительности к антибиотикам (EUCAST). Примеры таких приказов: №№ 167 (от 05.04.2007), 181 (от 04.04.2007), 221 (от 12.03.2010) и 234 (от 10.05.2007).
ВБИ часто характеризуется тяжелым клиническим течением и высокой летальностью, что обусловлено высокой устойчивостью госпитальной микрофлоры к антибактериальным препаратам.
Контингентом повышенного риска возникновения ВБИ являются:
Основными причинами возникновения ВБИ:
Главным источником госпитальных штаммов микроорганизмов являются:
Роль посетителей стационаров, как источник ВБИ – незначительная!
Механизмами распространения является:
В отдельном лечебном заведении удельный вес каждой причины и источника ВБИ будет очень индивидуальной.
Убытки, связанные с ВБИ:
Этиологическая природа ВБИ
Определяется широким кругом микроорганизмов (по современным данным, более 300), включает в себя как патогенную, так и условно-патогенную флору.
Основные возбудители ВБИ:
Микробы с приобретенной устойчивостью имеют преимущества перед другими представителями популяции, что приводит к их селекции и дальнейшего доминирования (формирования госпитального штамма).
Отличия госпитального штамма от обычного:
Рекомендации ВОЗ (к 1-му принципу):
При назначении за жизненными показаниями антибиотиков широкого спектра обязательно учитывается антибиотикограмма микрофлоры стационара!
Рекомендации ВОЗ (к 2-му принципу):
Небезопасные диагностические процедуры, во время которых может произойти заражение ВБИ:
Небезопасные лечебные процедуры, в результате которых возможно занесение ВБИ:
Какие последствия от действия антибиотикорезистентных бактерий, возбудителей ВБИ?
У нас микробиология нового уровня
Читайте также
Весь мир сейчас борется с распространением коронавируса. С 12 марта в Украине был введен карантин, для сдерживания роста числа заболевших. На данный момент известно, что вирус передается от человек..
Грибки – это уникальные создания, способные подстраивать условия окружающей среды под свои потребности. Многие грибковые патогены способны самостоятельно менять кислотность (pH) среды, что позволяет и..
Гелевое покрытие для ногтей стало настоящим прорывом в искусстве маникюра. Однако многие женщины отмечают, что после нанесения гель-лаков происходит деформация ногтевой пластины. Естественн..
Девушка, дайте мне самый лучший антибиотик! То, что антибиотик не работает при вирусной инфекции, знают уже все. Когда же нужен антибиотик и какой? Важно: каждый антибиотик действует только на опр..
Если вы заметили, что стали болеть гораздо чаще, вероятнее всего вашему организму не хватает витамина D. Одна из его важнейших функций стимуляция выработки кателицидинов (молекул, обладающих противоми..
ст.м. Житомирская
пр-т Победы, 119-121, корпус 5
ст.м. Оболонь
пр-т Оболонский, 14
Дарницкая площадь (Ленинградская)
пр-т Соборности, 8/2
Внутрибольничные инфекции
Внутрибольничные инфекции – различные инфекционные заболевания, заражение которыми произошло в условиях лечебного учреждения. В зависимости от степени распространения различают генерализованные (бактериемию, септицемию, септикопиемию, бактериальный шок) и локализованные формы внутрибольничных инфекций (с поражением кожи и подкожной клетчатки, дыхательной, сердечно-сосудистой, урогенитальной системы, костей и суставов, ЦНС и т. д.). Выявление возбудителей внутрибольничных инфекций проводится с помощью методов лабораторной диагностики (микроскопических, микробиологических, серологических, молекулярно-биологических). При лечении внутрибольничных инфекций используются антибиотики, антисептики, иммуностимуляторы, физиотерапия, экстракорпоральная гемокоррекция и т. д.
Общие сведения
Этиология и эпидемиология внутрибольничных инфекций
Основными возбудителями внутрибольничных инфекций (85% от общего числа) выступают условно-патогенные микроорганизмы: грамположительные кокки (эпидермальный и золотистый стафилококк, бета-гемолитический стрептококк, пневмококк, энтерококк) и грамотрицательные палочковидные бактерии (клебсиеллы, эшерихии, энтеробактер, протей, псевдомонады и др.). Кроме этого, в этиологии внутрибольничных инфекций велика удельная роль вирусных возбудителей простого герпеса, аденовирусной инфекции, гриппа, парагриппа, цитомегалии, вирусных гепатитов, респираторно-синцитиальной инфекции, а также риновирусов, ротавирусов, энтеровирусов и пр. Также внутрибольничные инфекции могут быть вызваны условно-патогенными и патогенными грибами (дрожжеподобными, плесневыми, лучистыми). Особенностью внутригоспитальных штаммов условно-патогенных микроорганизмов служит их высокая изменчивость, лекарственная резистентность и устойчивость к воздействию факторов среды (ультрафиолета, дезинфектантов и пр.).
Источниками внутрибольничных инфекций в большинстве случаев выступают пациенты или медицинский персонал, являющиеся бактерионосителями или больными стертыми и манифестными формами патологии. Как показывают исследования, роль третьих лиц (в частности, посетителей стационаров) в распространении ВБИ невелика. Передача различных форм госпитальной инфекции реализуется с помощью воздушно-капельного, фекально-орального, контактного, трансмиссивного механизма. Кроме этого, возможен парентеральный путь передачи внутрибольничной инфекции при проведении различных инвазивных медицинских манипуляций: забора крови, инъекций, вакцинации, инструментальных манипуляций, операций, ИВЛ, гемодиализа и пр. Таким образом в медучреждении возможно заразиться гепатитами В, С и D, гнойно-воспалительными заболеваниями, сифилисом, ВИЧ-инфекцией. Известны случаи внутрибольничных вспышек легионеллеза при приеме больными лечебного душа и вихревых ванн.
Факторами, участвующими в распространении внутрибольничной инфекции, могут выступать контаминированные предметы ухода и обстановки, медицинский инструментарий и аппаратура, растворы для инфузионной терапии, спецодежда и руки медперсонала, изделия медицинского назначения многоразового использования (зонды, катетеры, эндоскопы), питьевая вода, постельные принадлежности, шовный и перевязочный материал и мн. др.
Значимость тех или иных видов внутрибольничной инфекции во многом зависит от профиля лечебного учреждения. Так, в ожоговых отделениях преобладает синегнойная инфекция, которая в основном передается через предметы ухода и руки персонала, а главным источником внутрибольничной инфекции являются сами пациенты. В учреждениях родовспоможения основную проблему представляет стафилококковая инфекция, распространяемая медицинским персоналом-носителем золотистого стафилококка. В урологических отделениях доминирует инфекция, вызываемая грамотрицательной флорой: кишечной, синегнойной палочкой и др. В педиатрических стационарах особую значимость имеет проблема распространения детских инфекций – ветряной оспы, эпидемического паротита, краснухи, кори. Возникновению и распространению внутрибольничной инфекции способствуют нарушение санитарно-эпидемиологического режима ЛПУ (несоблюдение личной гигиены, асептики и антисептики, режима дезинфекции и стерилизации, несвоевременное выявление и изоляция лиц-источников инфекции и т. д.).
К группе риска, в наибольшей степени подверженной развитию внутрибольничной инфекции, относятся новорожденные (особенно недоношенные) и дети раннего возраста; пожилые и ослабленные пациенты; лица, страдающие хроническими заболеваниями (сахарным диабетом, болезнями крови, почечной недостаточностью), иммунодефицитом, онкопатологией. Восприимчивость человека к внутрибольничным инфекциям увеличивается при наличии у него открытых ран, полостных дренажей, внутрисосудистых и мочевых катетеров, трахеостомы и других инвазивных устройств. На частоту возникновения и тяжесть течения внутрибольничной инфекции влияет долгое нахождение пациента в стационаре, длительная антибиотикотерапия, иммуносупрессивная терапия.
Классификация внутрибольничных инфекций
По длительности течения внутрибольничные инфекции делятся на острые, подострые и хронические; по тяжести клинических проявлений – на легкие, среднетяжелые и тяжелые формы. В зависимости от степени распространенности инфекционного процесса различают генерализованные и локализованные формы внутрибольничной инфекции. Генерализованные инфекции представлены бактериемией, септицемией, бактериальным шоком. В свою очередь, среди локализованных форм выделяют:
Диагностика внутрибольничных инфекций
Критериями, позволяющими думать о развитии внутрибольничной инфекции, служат: возникновение клинических признаков заболевания не ранее чем через 48 часов после поступления в стационар; связь с проведением инвазивного вмешательства; установление источника инфекции и фактора передачи. Окончательное суждение о характере инфекционного процесса получают после идентификации штамма возбудителя с помощью лабораторных методов диагностики.
Для исключения или подтверждения бактериемии проводится бактериологический посев крови на стерильность, желательно не менее 2-3-х раз. При локализованных формах внутрибольничной инфекции микробиологическое выделение возбудителя может быть произведено из других биологических сред, в связи с чем выполняется посев мочи, кала, мокроты, отделяемого ран, материала из зева, мазка с конъюнктивы, из половых путей на микрофлору. Дополнительно к культуральному методу выявления возбудителей внутрибольничных инфекций используются микроскопия, серологические реакции (РСК, РА, ИФА, РИА), вирусологический, молекулярно-биологический (ПЦР) методы.
Лечение внутрибольничных инфекций
Сложности лечения внутрибольничной инфекции обусловлены ее развитием в ослабленном организме, на фоне основной патологии, а также резистентностью госпитальных штаммов к традиционной фармакотерапии. Больные с диагностированными инфекционными процессами подлежат изоляции; в отделении проводится тщательная текущая и заключительная дезинфекция. Выбор противомикробного препарата основывается на особенностях антибиотикограммы: при внутрибольничной инфекции, вызванной грамположительной флорой наиболее эффективен ванкомицин; грамотрицательными микроорганизмами – карбапенемы, цефалоспорины IV поколения, аминогликозиды. Возможно дополнительное применение специфических бактериофагов, иммуностимуляторов, интерферона, лейкоцитарной массы, витаминотерапии.
При необходимости проводится чрескожное облучение крови (ВЛОК, УФОК), экстракорпоральная гемокоррекция (гемосорбция, лимфосорбция). Симптоматическая терапия осуществляется с учетом клинической формы внутрибольничной инфекции с участием специалистов соответствующего профиля: хирургов, травматологов, пульмонологов, урологов, гинекологов и др.
Профилактика внутрибольничных инфекций
Основные меры профилактики внутрибольничных инфекций сводятся к соблюдению санитарно-гигиенических и противоэпидемических требований. В первую очередь, это касается режима дезинфекции помещений и предметов ухода, применения современных высокоэффективных антисептиков, проведения качественной предстерилизационной обработки и стерилизации инструментария, безукоснительного следования правилам асептики и антисептики.
Медицинский персонал должен соблюдать меры индивидуальной защиты при проведении инвазивных процедур: работать в резиновых перчатках, защитных очках и маске; осторожно обращаться с медицинским инструментарием. Большое значение в профилактике внутрибольничных инфекций имеет вакцинация медработников от гепатита В, краснухи, гриппа, дифтерии, столбняка и других инфекций. Все сотрудники ЛПУ подлежат регулярному плановому диспансерному обследованию, направленному на выявление носительства патогенов. Предупредить возникновение и распространение внутрибольничных инфекций позволит сокращение сроков госпитализации пациентов, рациональная антибиотикотерапия, обоснованность проведения инвазивных диагностических и лечебных процедур, эпидемиологический контроль в ЛПУ.
Что способствует распространению нозокомиальных инфекций
Под нозокомиальными (от латинского «nosocomium» — больница и греческого «nosokomeo» — ухаживать за больным) инфекциями понимают любое клинически определяемое инфекционное заболевание, которое развивается у пациента при обращении в больницу за медицинской помощью или при пребывании в ней, а также любое инфекционное заболевание, которое развивается у сотрудника больницы вследствие его работы в данном учреждении [1]. К нозокомиальным относят инфекции, которые не находились в инкубационном периоде и не проявлялись клинически в момент поступления пациента в больницу, и развились не ранее, чем через 48 часов после госпитализации, а также инфекции, возникшие вследствие предшествовавшей госпитализации [2].
Эпидемиология нозокомиальных инфекций
Крупные исследования в США и Европе показали, что за последние два десятилетия произошли изменения в частоте, локализации, и распределении этиологических факторов нозокомиальных инфекций [7–9]. Появление новых возбудителей оппортунистических инфекций привело к возникновению новых проблем антибиотикорезистентности.
В начале гг. прошлого века, по данным исследования SENIC (Study of Efficacy of Nosocomial Infection Control), первое место среди нозокомиальных инфекций занимали инфекции мочевыводящих путей (42 %) и хирургическая раневая инфекция (24 %) [6]. Инфекции дыхательных путей составляли примерно 11 %.
В начале гг. частота нозокомиальной пневмонии увеличилась до 15–17 %, в 1995 г. превысила 30 %, а в последних европейских исследованиях были получены ещё более высокие цифры — 46,9 % [7–10]. Таким образом, нозокомиальная пневмония выходит в Европе на первое по частоте место среди всех нозокомиальных инфекций.
За последние 15–20 лет отмечается рост частоты ангиогенных инфекций [12]. В частности, в США частота первичной и вторичной бактериемии увеличилась за период с 1979 по 1987 гг. в 2,4 раза [13]. В зависимости от размеров лечебного учреждения, контингента больных и длительности пребывания в стационаре она составляет 1,3–14,5 на 1000 госпитализированных больных [14].
Рост вторичной бактериемии связывают с широким применением инвазивных процедур, противоопухолевой химиотерапии и иммунотерапии, способствующих развитию сепсиса и септического шока [7]. Однако наиболее часто вторичная бактериемия развивается у больных с нозокомиальной пневмонией. Частота первичной бактериемии остается относительно стабильной и находится на уровне 15 % [7–9].
Бактериемия, наряду с пневмонией, относится к наиболее тяжелым нозокомиальным инфекциям, часто приводящим к летальным исходам, причем за последние 40 лет отмечен экспоненциальный рост частоты летальных исходов вследствие бактериемии [16].
К числу распространенных нозокомиальных инфекций относится также раневая инфекция. Так, по данным многоцентрового исследования, включавшего 231 больницу в США, в период с октября 1986 по апрель 1996 гг. раневая инфекция занимала второе место среди всех микробиологически подтвержденных нозокомиальных инфекций (17,4 %), уступая по частоте лишь инфекциям мочевыводящих путей (34,5 %) [17]. По данным других исследований, частота нозокомиальной раневой инфекции и инфекции кожи и мягких тканей составляет в отделениях хирургического профиля и ожоговых центрах в среднем 8–15 % [18, 19].
К более редким инфекциям относят вторичный нозокомиальный менингит и гастроэнтерит. У пациентов с факторами риска возможно развитие псевдомембранозного энтероколита, вызванного Clostridium difficile. В последние годы в Северной Америке и Европе наблюдается рост частоты нозокомиального туберкулеза [6, 8, 11].
Средняя частота развития нозокомиальных инфекций составляет в экономически развитых странах примерно 5–6 на 100 госпитализаций [3]. Их распространенность значительно варьирует в разных стационарах и отделениях больниц. Она наиболее высока в крупных городских больницах, особенно в отделениях интенсивной терапии.
Этиология и патогенез нозокомиальных инфекций
Нозокомиальные инфекции могут иметь эндогенное и экзогенное происхождение. Более 80 % из них являются эндогенными. В этом случае колонизация пациента микроорганизмами происходит ещё до его поступления в лечебное учреждение. Передача экзогенной инфекции происходит уже в стационаре при непосредственном контакте с пациентом или через контаминированные диагностические и терапевтические устройства и материалы.
Основными факторами, способствующими возникновению и распространению нозокомиальных инфекций, являются необоснованно широкое и нерациональное использование антибактериальных средств в лечебных учреждениях, несоблюдение правил гигиены медицинским персоналом, в частности, мытья рук между осмотрами пациентов, и снижение иммуннокомпетентности больных в связи с общим постарением населения, увеличением числа сопутствующих заболеваний и нарушений физиологических функций органов [3].
К другим факторам, способствующим развитию нозокомиальных инфекций, относятся применение внутрисосудистых устройств, уретральных катетеров, эндотрахеальных трубок и аппаратов искусственного дыхания, иммуносупрессивная и лучевая терапия, гемотрансфузии и хирургические вмешательства [20]. Отдельно следует выделить пересадку органов, которая сочетает в себе несколько факторов риска: хирургическое вмешательство, иммунносупрессию и инфицирование трансплантата [3]. Кроме того, риск возникновения грибковых инфекций возникает вследствие высвобождения спор и пыли в процессе капитального ремонта лечебных учреждений. Аналогичный риск существует и для некоторых других патогенов, например, легионелл [3].
C начала эры антибиотиков можно проследить эволюцию основных возбудителей нозокомиальных инфекций. В первые годы антибиотикотерапии внутрибольничные инфекции были обусловлены преимущественно стафилококками и хорошо поддавались лечению пенициллинами [21]. Затем появились стафилококки, продуцирующие беталактамазу, для борьбы с которыми стали применять беталактамазоустойчивые антибиотики. На следующем этапе основными возбудителями нозокомиальных инфекций стали метициллинорезистентный Staphylococcus aureus (MRSA) и грамотрицательные бациллы. В конце гг. важную роль в качестве этиологического фактора нозокомиальных инфекций приобрели представители семейства Enterobacteriaceae (Klebsiella spp., Serratia spp.) [21, 22], в 1975–1980 гг. появились мультирезистентные грамотрицательные бактерии — Pseudomonas aeruginosa и Acinetobacter spp. [23, 24].
Этиологическое значение P. aeruginosa и Acinetobacter spp., как показывают недавние исследования, продолжает увеличиваться. В большинстве последних исследований также показано возрастание этиологической роли грамположительных кокков, включая и коагулазоотрицательные стафилококки, стрептококки и энтерококки [25]. Значительно повысилась частота выделения мультирезистентного Staphylococcus aureus [26]. В то же время частота инфекций, вызванных Escherichia coli и Klebsiella pneumoniae, снизилась соответственно с 23 % до 16 % и с 7 % до 5 % [21, 27]. К новым возбудителям нозокомиальных инфекций относят грамположительные микроорганизмы jeikeium и Rhodococcus equi и грамотрицательные cepacia, Stenotrophomonas maltophilia и Alcaligenes xylosooxydans В США в 1990–96 гг. три наиболее распространенных грамположительных возбудителя (S. aureus, когулазонегативные стафилококки и энтерококки) были этиологическими факторами 34 % всех нозокомиальных инфекций, а четыре грамотрицательных возбудителя (Escherichia сoli, P. aeruginosa, Enterobacter spp., and Klebsiella pneumoniae) — 32 % [3].
Частота выделения различных патогенов в зависимости от локализации инфекции представлена в таблице 1. Грамотрицательные микроорганизмы преобладают среди возбудителей ожоговой раневой инфекции, в то время как грамположительные микроорганизмы являются ведущей причиной бактериемии [26, 28]. У больных с нозокомиальной пневмонией, по данным исследования EPIIC, наиболее распространенными патогенами являются P. aeruginosa и S. aureus, которые выделяются примерно с одинаковой частотой [9, 21, 24]. Существует мнение, что около половины нозокомиальных инфекций в настоящее время вызываются антибиотикорезистентными микроорганизмами [29].
Частоты выделения основных возбудителей нозокомиальных инфекций в Северной Америке и Европе существенно не отличаются. Следует отметить лишь более высокую распространенность энтерококков в США и Acinetobacter spp. в европейских странах [5].
Эмпирическая терапия нозокомиальных инфекций
Нозокомиальные инфекции часто имеют тяжелое течение, особенно у иммуннокомпрометированных больных, лиц пожилого возраста, пациентов с нейтропенией и тяжелыми сопутствующими заболеваниями. В связи с необходимостью неотложного лечения антибиотики обычно назначают эмпирически. Выбор антибиотика основывают на клинической картине заболевания, знании основных возбудителей, характерных для инфекции определенной локализации, и их распространенности, состоянии локальной антибиотикорезистентности.
Спектр антибактериальной активности эмпирически назначаемого антибиотика должен быть достаточно широким и включать большинство грамотрицательных бацилл, резистентные P. aeruginosa, Serratia marcescens, Enterobacter cloacae и A. baumannii, особенно при нозокомиальной пневмонии [5]. Обычно рекомендуют комбинации антисинегнойного пенициллина или цефалоспорина с аминогликозидом. Однако в ситуациях, когда можно предположить грамположительную этиологию, например MRSA (в медицинских учреждениях, где этот микроорганизм является эндемичным), эмпирическая терапия должна включать гликопептид [5].
Активностью в отношении стафилококков обладают также рифампицин, клиндамицин, фузидиевая кислота и стрептограмины. Однако комбинации фузидиевой кислоты и рифампицина с другими препаратами способны приводить к селекции резистентных мутантов, поэтому их следует применять только под тщательным контролем теста на чувствительность [5].
Во время вспышек нозокомиальных инфекций, когда существует высокая вероятность перекрестной передачи мультирезистентного микроорганизма, такого как P. aeruginosа, следует назначать карбапенемы (имипенем/циластатин, меропенем) в комбинации с аминогликозидом (амикацин) или фторхинолоном (ципрофлоксацин) [30].
Клинический ответ на назначенную терапию оценивают через 2–3 дня. При необходимости лечение корригируют в соответствии с результатами микробиологического исследования. В ситуациях, когда позволяет клиническое состояние, пациента можно перевести на менее дорогие и менее токсичные антибактериальные средства [5].
При подозрении на смешанную флору, например, в случае хирургической полимикробной инфекции брюшной полости или аспирационной пневмонии, рекомендуется добавление клиндамицина, цефокситина или метронидазола [31]. Альтернативным препаратом для лечения смешанной аэробноанаэробной инфекции явлется имипенем [5].
У больных с атипичной пневмонией при подозрении на легионеллез, антибиотиками выбора являются внутривенный эритромицин и рифампицин в виде моно- или комбинированной терапии [32].
Крайне важным является выявление ранних стадий сепсиса и нарушения функции органов. В данной ситуации массивное высвобождение микробного эндотоксина может привести к синдрому недостаточности или дисфункции сразу нескольких органов [30, 33]. Микроорганизмы, способствующие ухудшению состояния, происходят преимущественно из тракта (E. coli, Bacteroides fragilis, энтерококки) или являются вторично приобретенными нозокомиальными бактериями (P. aeruginosа). В этих случаях следует ограничить применение антибиотиков с широким спектром действия и использовать препараты с узким спектром, включающим специфические микроорганизмы [5].
Эмпирическая антибиотикотерапия нейтропенической лихорадки (при количестве нейтрофилов 500/мм 3 и температуре тела выше ) может включать применение одной из следующих трех схем [34, 35]:
Лечение идентифицированной нозокомиальной инфекции
При идентифицированной (задокументированной) нозокомиальной инфекции выбор терапии должен основываться на результатах микробиологического исследования. При решении вопроса о назначении монотерапии или комбинации антибиотиков следует руководствоваться результатами теста на чувствительность как отдельных антибиотиков, так и их комбинаций. При выборе лечения необходимо также учитывать клиническое состояние пациента, степень тяжести подлежащего терапии заболевания, наличие различных устройств (катетеров, оборудования для искусственной вентиляции легких, протезов ).
Выбранный антибиотик (или комбинация антибиотиков) должен обладать благоприятными фармакокинетическими свойствами, обеспечивающими адекватное поступление препарата в инфицированные ткани (что также зависит от дозы и пути введения) и при необходимости внутрь клетки или через тканевые барьеры (например, гематоэнцефалический), создавать достаточные концентрации активной свободной фракции в крови. Следует помнить, что широко применяемые в комбинированной терапии аминогликозиды подвергаются инактивации при низком рН [5].
К сожалению, не всегда можно ориентироваться на спектр активности антибиотика, определенный in vitro [5]. Взаимодействие между бактерией и антибиотиком, происходящее in vivo, особенно при нозокомиальной инфекции, намного сложнее, чем in vitro, и зависит от многочисленных факторов со стороны микроорганизма. Так, цефтазидим или цефтриаксон обладают в организме высокой активностью в отношении грамотрицательных микроорганизмов, но оказывают слабое действие на S. aureus. Имипенем/циластатин обладает широким спектром активности, но одновременно и высоким потенциалом формирования резистентности при синегнойной инфекции.
В литературе дискутируется вопрос, имеет ли комбинированная терапия преимущества перед монотерапией. Во многих ретроспективных исследованиях показано, что комбинированная терапия превосходит по эффективности монотерапию при анаэробной грамотрицательной бактериемии. Так, в рандомизированном исследовании, проведенном Европейской организацией по исследованию и лечению рака (The European Organisation for Research and Treatment of Cancer), цефтазидим в сочетании с длительным применением амикацина оказывал терапевтический эффект у 81 % больных, в то время как короткий курс амикацина был эффективен у 48 % пациентов. Кроме того, после проведения короткого курса амикацина чаще развивались повторные инфекции, бактериемия, вызванная P. aeruginosа [36].
По данным ретроспективных исследований, частота выживания у пациентов с грамотрицательной бактериемией составила 77 % при применении двух антибиотиков по сравнению с 50 % среди больных, получавших один антибиотик. Однако это различие имело недостоверный характер [37]. В то же время у больных с раком и гранулоцитопенией не наблюдалось различий в эффективности меропенема и стандартной комбинации цефтазидима и амикацина. Аналогичные результаты были получены в сравнительном исследовании цефтазидима и комбинации цефтриаксона с тобрамицином или амикацином [38, 39]. Результаты ряда исследований показали, что монотерапия нозокомиальной пневмонии цефалоспорином III поколения, имипенемом или фторхинолоном в целом не уступает по эффективности комбинированной терапии [5]. Однако у пациентов с тяжелой инфекцией, вызванной мультирезистентнными P. aeruginosа, К. pneumoniae, A. baumannii, более эффективным оказалось применение комбинации антисинегнойного беталактамного антибиотика с аминогликозидом [32].
Литературные данные об эффективности разных комбинаций антибиотиков достаточно противоречивы. Например, в одних публикациях утверждается, что пенициллины в сочетании с гликопептидом оказывают синергический эффект в отношении высокорезистентных к ванкомицину энтерококков [40]. Однако в других работах не продемонстрировано синергитического эффекта у комбинации ампициллина с ванкомицином в отношении ванкомицинрезистентного E. faecium [41]. Поэтому синергизм антибиотиков, входящих в комбинацию, в каждом случае необходимо подтверждать результатами микробиологического исследования [5].
Лечение инфекций, вызванных грамотрицательными микроорганизмами
Для монотерапии грамотрицательных нозокомиальных инфекций используют цефалоспорины поколения (цефтазидим, цефпиром, цефепим) или монобактам азтреонам [5]. Последний имеет узкий спектр активности, включающий грамотрицательные микроорганизмы. Цефалоспорины, обладающие широким спектром действия, имеют некоторые недостатки, в частности, вызывают дерепрессию цефалоспориназ класса I [42]. Важным достоинством цефалоспоринов IV поколения (цефпиром, цефепим) по сравнению с цефотаксимом/цефтазидимом является повышенная антистафилококковая активность и быстрое проникновение внутрь клетки.
Для лечения грамотрицательных инфекций, особенно тяжелой пневмонии или инфекций мочевыводящих путей, применяют также комбинации беталактамного антибиотика с ингибитором беталактамаз, например амоксициллин/клавуланат или пиперациллин/тазобактам. В связи с высокой частотой цефалоспориназопродуцирующих возбудителей нозокомиальных инфекций среди, например, Enterobacter spp. или аэробных мультирезистентных бактерий, приводящей к неэффективности лечения цефалоспоринами III поколения, нередко предпочтение отдают карбапенемам [39, 43]. Для монотерапии нозокомиальной пневмонии может также применяться внутривенный ципрофлоксацин. В сравнительном рандомизированном двойном слепом исследовании не было показано достоверной разницы в эффективности ципрофлоксацина и имипенема [43].
В целом при грамотрицательных нозокомиальных инфекциях монотерапия используется реже, чем комбинированная терапия. Наиболее распространенными являются стандартные комбинации беталактамного антибиотика с аминогликозидом, обладающие широким спектром антибактериальной активности. При нозокомиальной инфекции, вызванной P. aeruginosа, показана также эффективность комбинации ципрофлоксацина с цефтазидимом. Кроме того, комбинации фторхинолонов с беталактамными антибиотиками (уреидопенициллин, цефтазидим или имипенем), снижают риск появления резистентности у S. pneumoniae, S. marcescens, E. cloacoae и P. aeruginosа. При нозокомиальных инфекциях, вызванных P. aeruginosа, синергический эффект оказывает комбинация ципрофлоксацина с фосфомицином, вызванных Acinetobacter — комбинация ципрофлоксацина и имипенема [44].
Лечение инфекций, вызванных грамположительными микроорганизмами
Среди возбудителей грамположительных нозокомиальных инфекций особую проблему представляют метициллинорезистентные стафилококки, проявляющие также к рифампицину, аминогликозидам и фторхинолонам. В настоящее время препаратами выбора для лечения инфекций, вызванных MRSA, являются ванкомицин и тейкопланин. Однако в последние годы появились сообщения о снижении чувствительности MRSA и коагулазонегативных стафилококков к гликопептидам [45].
При инфекциях, не поддающихся лечению ванкомицином, имипенемом, гентамицином и ципрофлоксацином, обычно выделяют мультирезистентные стафилококки и E. faecium. Многообещающие результаты были получены при лечении инфекций, вызванных этими микроорганизмами, хинупристином/дальфопристином — новым препаратом из группы стрептограминов. В клинических исследованиях у 234 пациентов с инфекциями, возбудителем которых являлся ванкомицинорезистентный E. faecium, положительные результаты при применении хинупристин/дальфопристина наблюдались в 63 % случаев, при бактериемии — в 60 %, интраабдоминальных инфекциях — в 23 %, катетероассоциированной бактериемии — в 10 % и эндокардите — в 4 % [46].
Выбор антибиотиков для лечения нозокомиальных инфекций в зависимости от возбудителя представлен в таблице 2.
Лечение нозокомиальной инфекции различной локализации
В паренхиме легких и бронхах концентрации, необходимые для подавления большинства высоко и умеренно чувствительных возбудителей нозокомиальной пневмонии, создают пенициллины, цефалоспорины III поколения и фторхинолоны. Однако множественные механизмы резистентности, характерные для двух основных возбудителей пневмонии — P. aeruginosа и S. aureus, делают необходимым использование комбинации синергидных антибиотиков (беталактам + аминогликозид). В связи с появлением штаммов S. aureus и энтерококков с пониженной чувствительностью к ванкомицину необходимо внедрение в медицинскую практику новых антибактериальных средств, таких как хинупристин/дальфопристин.
Один из основных возбудителей внебольничной пневмонии S. pneumoniae в настоящее время рассматривается и как потенциальный возбудитель нозокомиальной инфекции [47]. Распространение резистентности S. pneumoniae к пенициллинам и большинству других беталактамных антибиотиков приобрело масштабы серьезной проблемы в большинстве регионов мира [48, 49]. Для лечения пневмонии, вызванной резистентными штаммами S. pneumoniae, используют высокие дозы бензилпенициллина или цефалоспорины поколения (цефтриаксон, цефепим или цефпиром) [5].
В некоторых случаях, например, при тяжелой синегнойной пневмонии или суперинфекции при муковисцидозе, необходимо создание очень высоких тканевых концентраций антибиотика. Их можно достичь при локальной антибиотикотерапии [50]. Хороший эффект оказывают при местном применении аминогликозиды (гентамицин, тобрамицин и амикацин), карбенициллин и цефтазидим [5]. Применение аминогликозидов может приводить к снижению максимального объема выдоха, но в целом они хорошо переносятся больными.
Бактериемия наиболее часто развивается на фоне нозокомиальной пневмонии и инфекций мочевыводящих путей. К другим важным источникам относятся инфекции кожи и мягких тканей, хирургические раны. Основными возбудителями бактериемий являются грамположительные микроорганизмы. Так, в европейских странах их выделяют в 61 % случаев [51]. Наиболее распространенными возбудителями бактериемий, развивающихся при применении внутрисосудистых устройств, являются MRSA и коагулазонегативные стафилококки.
Лечение катетероассоциированных стафилококковых инфекций представляет собой серьезную проблему [52]. Коагулазонегативные стафилококки продуцируют экстрацеллюлярную слизистую матрицу, в которой оседают бактерии и которая препятствует проникновению антибиотиков. В этом случае традиционная противомикробная терапия не позволяет достичь эрадикации бактерий. Потенциальным лечебным эффектом обладает продолжающаяся внутривенная инфузия имипенема в сочетании с фосфомицином, ванкомицином или аминогликозидом, однако в большинстве случаев основным терапевтическим мероприятием является удаление внутривенного катетера [5].
Смертность при бактериемии, вне зависимости от источника инфекции, составляет 25–50 % [15,53]. Выбор антибиотика должен основываться на данных микробиологического исследования. При назначении лечения следует также учитывать источник инфекции и наличие признаков сепсиса. В большинстве случаев одна антибиотикотерапия, даже адаптированная к выделенному возбудителю, не позволяет достичь терапевтического эффекта. В дополнение к антибиотикотерапии рекомендуют назначение антиэндотоксиновых антител или новых схем лечения, включающих антиэндотоксины и антицитокины [15].
Инфекции кожи и мягких тканей
Среди тяжелых нозокомиальных инфекций кожи и мягких тканей, которые обычно имеют полимикробную этиологию, особенно трудно поддаются лечению инфекции при ожогах. Наряду с местным применением дезинфицирующих средств (0,5 % раствор нитрата серебра, 10 % крем мафенида ацетата в сульфадиазине серебра), для профилактики раневой инфекции назначают системные антибиотики [18]. Проведение стандартной системной антибиотикотерапии рекомендуют сразу же после получения ожога, когда снижены защитные силы организма, и во время иссечения колонизированного микроорганизмами ожогового струпа, который является важным источником бактериемии [5].
Для лечения инвазивной инфекции следует как можно раньше назначать мощную комбинацию системных антибиотиков, эффективную в отношении специфического возбудителя [5]. Наиболее частыми возбудителями являются P. aeruginosа и S. aureus, реже — A. baumannii. Однако лечение часто приводит к возникновению резистентности вследствие высокого локального микробного числа и ограниченного проникновения антибиотиков к месту ожога.
Педиатрические нозокомиальные инфекции
Дети, наряду с лицами пожилого возраста, являются группой риска развития нозокомиальных инфекций. Частота возникновения нозокомиальных инфекций у детей обратно пропорциональна возрасту. У новорожденных, помимо факторов риска, характерных для взрослых, к развитию нозокомиальных инфекций предрасполагают незрелость защитных механизмов гуморального и клеточного иммунитета.
Профилактика нозокомиальных инфекций
В эпидемиологическом исследовании SENIC было показано, что внедрение программ инфекционного контроля, основанного на данных эпидемиологического мониторинга, позволяет предотвратить 32 % нозокомиальных инфекций [55]. В Северной Америке и Европе разработано большое количество рекомендаций по их профилактике, основанных на консенсусе специалистов. В больницах экономически развитых стран функционируют специальные инфекционные комитеты, в обязанности которых входит контроль и профилактика нозокомиальных инфекций.
К важным профилактическим мерам относятся соблюдение чистоты в медицинском учреждении и правил асептики при проведении инвазивных процедур, тщательная стерилизация медицинских инструментов [3]. Особое внимание уделяется мытью и протиранию рук спиртовыми растворами до и после контакта с пациентом [56].
В рекомендациях по профилактике нозокомиальных инфекций можно выделить 3 основных подхода [5]:
В ситуациях, когда существует высокий риск инфицирования и Klebsiella, проводят специфическую иммунопрофилактику [57]. Кроме того, пациентам, находящимся в палатах интенсивной терапии, рекомендуют проведение селективной деконтаминации кишечника, направленной на профилактику колонизации ротоглотки и кишечника потенциально патогенными бактериями [58]. Однако в последнее время эффективность селективной деконтаминации кишечника у пациентов, находящихся на искусственной вентиляции легких, вызывает сомнения. Несмотря на то, что она приводит к снижению частоты инфекций нижних дыхательных путей, летальность от них практически не изменяется [58]. Также остается неясным, способствует ли селективная деконтаминация кишечника уменьшению сроков госпитализации больных [5]. Дискутируется вопрос о риске возникновения резистентности при проведении селективной деконтаминация кишечника c повышением частоты выделения аминогликозидорезистентных энтерококков и MRSA [59].
Для местной химиопрофилактики используют плохо всасывающиеся антибиотики: полимиксин Е, тобрамицин (или норфлоксацин) и амфотерицин В (для профилактики колонизации грибами). В большинстве исследований одновременно с местной профилактикой применяли инъекционный цефотаксим. Комбинации антибиотиков могут наноситься на слизистую оболочку полости рта в форме липких паст или вводиться через назогастральный зонд.
Таким образом, нозокомиальные инфекции продолжают оставаться серьезной угрозой здоровью и жизни, особенно у пациентов с факторами риска. Для снижение частоты заболеваемости и смертности, вызванных нозокомиальными инфекциями, необходимо улучшать инфекционный контроль и уход за больными, совершенствовать методы диагностики и внедрять в клиническую практику новые противомикробные средства.