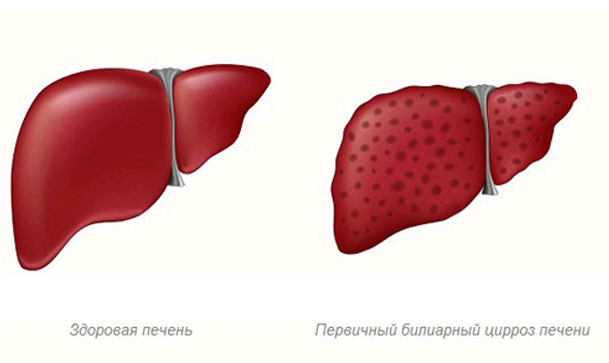
Что специфично для первичного билиарного цирроза печени тест
Первичный билиарный цирроз (K74.3)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Клиническая классификация (Hubscher S.G., 2000)
Этиология и патогенез
Эпидемиология
Возраст: зрелый возраст
Соотношение полов(м/ж): 0.1
Первичный билиарный цирроз встречается по всему миру, при этом заболеваемость в разных странах и в разных областях одной страны значительно (в разы) различается, поэтому международная статистика недоступна.
В настоящее время распространенность определяется в США в популяции как 35:100 000.
Заболеваемость была оценена как 4,5 случаев для женщин и 0,7 случаев для мужчин (2,7 случаев в целом) на 100 000 населения.
В связи с улучшением диагностики и повышением осведомленности врачей отмечается повышение частоты выявления заболевания. При диагностике стало возможно выявление больных на ранних стадиях заболевания, которые протекают с минимальной симптоматикой, благодаря постановке реакции на сывороточные антимитохондриальные антитела.
Заболевание может иметь семейный характер: первичный билиарный цирроз описан у сестер, близнецов, у матерей и дочерей.
Факторы и группы риска
— наличие иных аутоиммунных заболеваний.
Инфицирование возбудителем семейства Enterobacteriaceae (вялая инфекция мочевыводящих путей, вызванная грамотрицательными микроорганизмами) в настоящее время обсуждается как недоказанный фактор риска. Дискуссия связана со сходством антигенной структуры клеточной мембраны Enterobacteriaceae и митохондрий клеток человека, и, таким образом, выявляемой кросс-реактивностью антимитохондриальных антител, которые являются основным маркером первичного билиарного цирроза.
Клиническая картина
Клинические критерии диагностики
Cимптомы, течение
Протоколы диагностики и лечения первичного билиарного цирроза печени в РБ
Первичный билиарный цирроз – хроническое холестатическое гранулематозное деструктивное воспалительное заболевание междольковых и септальных желчных протоков, предположительно обусловленное аутоиммунными реакциями и способное прогрессировать до цирроза или быть ассоциированным с циррозом.
Первичный билиарный цирроз согласно МКБ-10 классифицируется как:
Клиническими критериями первичного билиарного цирроза являются:
Диагностика при первичном билиарном циррозе
Обязательная диагностика:
Дополнительная диагностика:
Диагностические критерии первичного билиарного цирроза
Оценка степени тяжести первичного билиарного цирроза
| Стадия | Лимфоцитарный холангит | Цветущее повреждение протоков | Дуктопения |
|---|---|---|---|
| I | 2-4+ | Часто | 0 |
| II | 2-4+ | Часто | 1+ |
| III | 2-4+ | Часто | 1-3+ |
| IV | 0-2+ | Редко | 3-4+ |
Формулировка диагноза первичного билиарного цирроза включает:
Цели лечения первичного билиарного цирроза
Показания для госпитализации пациента с первичным билиарным циррозом
Лечение билиарного цирроза
Представительство
компании “Dr. Reddy’s Laboratories Limited”
г. Минск, ул.Тимирязева,
72-22, 53
Республиканский гастроэнтерологический центр (РЦГ) на базе УЗ “10-я городская клиническая больница”
Первичный билиарный цирроз
Симптомы
На ранней стадии первичный билиарный цирроз может протекать бессимптомно или маскироваться под проявления других заболеваний. По мере прогрессирования поражения печени могут наблюдаться следующие проявления.
Лабораторные признаки. При таком циррозе наблюдаются характерные биохимические отклонения: повышение билирубина, щелочной фосфатазы, трансаминаз АЛТ и АСТ, гамма-глутамилтранспептидазы (ГГТП). Кроме того, у больных изменяются показатели липидного спектра. Во многих случаях при исследовании гуморального иммунитета выявляется повышенный уровень иммуноглобулина класса М. Также нередко обнаруживается увеличение СОЭ и умеренная анемия.
Осложнения
Внутрипеченочный холестаз при первичном билиарном циррозе способен стать причиной недостатка желчи в кишечнике, что может сопровождаться стеатореей (увеличением количества жировых компонентов в стуле), развитием дефицита жирорастворимых витаминов, нарушениями минерализации костей и, как следствие, возникновением остеопороза. При прогрессировании заболевания печени больные постепенно худеют, у них обычно появляются такие симптомы, как расстройство зрения, боли в костях, кровоточивость десен, возможны патологические переломы.
Лечение
Применение кортикостероидов. Чтобы добиться регрессии клинической симптоматики заболевания, могут назначаться кортикостероидные гормоны (преднизолон или его аналоги). Применение таких препаратов может способствовать улучшению биохимических и гистологических параметров, увеличению продолжительности жизни.
Симптоматическая терапия. Для снижения кожного зуда обычно назначают сорбенты и средства, которые могут уменьшать поступление желчных кислот в энтерогепатическую циркуляцию. При стеаторее и дефиците желчи в кишечнике могут применять ферментные препараты с высоким уровнем липазы. Если больного беспокоят сильные боли в костях, может быть показано парентеральное введение препаратов кальция. Они также используются для предупреждения и лечения остеопороза.
Хирургическое лечение. Трансплантация печени может назначаться при превышении уровня сывороточного билирубина свыше 150 мкмоль/л, признаках декомпенсации процесса (печеночная энцефалопатия, повторяющиеся кровотечения из вен пищевода и т. д.). До развития цирроза хирургическое лечение может применяться в связи с тяжелым остеопорозом, непереносимым кожным зудом, значительным снижением качества жизни.
1 Согласно инструкции по медицинскому применению препарата.
Клинико-лабораторные критерии диагностики первичного билиарного цирроза и современная терапия
Цель обзора. Обобщить литературные и собственные данные по клинико-лабораторным критериям диагностики и лечения первичного билиарного цирроза (ПБЦ).
Основные положения. ПБЦ – органо-специфическое аутоиммунное заболевание печени, преимущественно поражающее женщин и характеризующееся хронической прогрессирующей деструкцией внутрипеченочных желчных протоков с портальным воспалением, приводящим к развитию цирроза печени (ЦП).
Авторы выделяют: АМА-позитивный (классический) вариант ПБЦ с кожным зудом, желтухой, наличием биохимических признаков холестаза и выявлением в сыворотке крови антимитохондриальных аутоантител (АМА) в диагностическом титре (более 1:40); АМА-негативный вариант ПБЦ с меньшей биохимической и иммунологической активностью, более низкой частотой внепеченочных проявлений, что, однако, не влияет на прогноз и сроки прогрессирования ЦП; перекрестный синдром (overlapsyndrome) с аутоиммунным гепатитом (АИГ) – ПБЦ/ АИГ (9,4%); бессимптомное течение ПБЦ, характеризующееся отсутствием клинических проявлений ПБЦ в течение длительного периода и манифестацией заболевания на стадии осложнений ЦП.
Урсодезоксихолевая кислота (УДХК) приводит к значительному уменьшению интенсивности кожного зуда (или его полному купированию), улучшению или нормализации биохимических показателей печени и гистологической картины, замедлению прогрессирования фиброза и цирроза печени, а также к снижению портальной гипертензии. Предложена комбинированная терапия УДХК и будесонидом.
Заключение. УДХК служит патогенетически обоснованной терапией ПБЦ.
Ключевые слова:
первичный билиарный цирроз, клинико-лабораторные признаки ПБЦ, урсодезоксихолевая кислота
Основные клинические проявления ПБЦ и его осложнения
К клиническим проявлениям ПБЦ относятся:
• кожный зуд;
• желтуха;
• гиперпигментация кожных покровов;
• ксантомы, ксантелазмы
• увеличение печени и реже – увеличение селезенки;
• похудание;
• слабость, утомляемость;
• снижение работоспособности;
• синдром нарушенного всасывания;
• остеодистрофия, остеопороз;
• холелитиаз;
• внепеченочные проявления иммунной природы.
ПБЦ в течение многих лет протекает скрытно и малосимптомно [14, 15]. Начинается незаметно и достаточно длительно проявляется лишь общей слабостью и/или снижением работоспособности. Причем астенический синдром у таких больных более выражен, чем при других хронических заболеваниях печени. В то же время высказывается мнение о том, что утомляемость у пациентов с ПБЦ нередко обусловлена сопутствующей депрессией [16].
Ведущим патогномоничным симптомом при ПБЦ является появление кожного зуда, который может быть единственным в течение нескольких месяцев и даже лет проявлением болезни. В его характеристике отмечают распространенность (локальный или общий), выраженность (умеренный или резко выраженный), продолжительность (постоянный или волнообразный). Кожный зуд более выражен в ночное время и часто усиливается при соприкосновении с тканями, а также в тепле. На коже отмечаются многочисленные следы расчесов, на месте которых позже появляются участки гиперпигментации.
Зуд не снимается симптоматическими (антигистаминными, седативными) препаратами, часто вызывает мучительную бессонницу, изменения эмоционального состояния, депрессию. В связи с этим пациенты нередко обращаются к дерматологу, аллергологу или неврологу.
В настоящее время кожный зуд рассматривается как вариант боли, а причину его возникновения связывают с состоянием опиоидной системы (эндорфины). Эндогенные липофильные желчные кислоты, вероятно, способствуют высвобождению до сих пор неизвестных субстанций, которые стимулируют опиоидные рецепторы. Однако у небольшой части обследуемых кожный зуд может отсутствовать весь период заболевания, практически до развития терминальных осложнений.
Наблюдаются разнообразные изменения кожи. В частности, при избыточном биосинтезе меланина в меланоцитах возникает гиперпигментация кожных покровов. Начальная реакция биосинтеза меланинов катализируется медьсодержащим ферментом тирозиназой. По одной из гипотез, увеличение содержания меди в сыворотке крови больных ПБЦ может приводить к повышению активности тирозиназной реакции и повышенному биосинтезу меланинов, отложение которых в коже и вызывает гиперпигментацию [1]. Накопление меди придает бронзовый оттенок кожным покровам.
Кроме того, при ПБЦ появляются ксантелазмы на коже верхних и нижних век и ксантомы – в области суставов, сухожилий, ягодиц и др. По некоторым данным, ксантелазмы образуются при сохраняющейся не менее 3 мес повышенной концентрации холестерола в крови (более 400 мг/дл) и могут исчезать при нормализации его уровня, а также на поздней стадии заболевания вследствие прогрессирования гепатоцеллюлярного повреждения.
Желтуха также относится к наиболее важным клиническим симптомам ПБЦ, но может длительное время (до 2 лет) отсутствовать. Примерно у четверти больных отмечается одновременное появление желтухи и кожного зуда. На ранних стадиях заболевания желтуха имеет, как правило, волнообразный характер. В дальнейшем наблюдается ее неуклонное прогрессирование при одновременном увеличении содержания прямого билирубина в крови. У пациентов с ПБЦ возможны индивидуальные колебания уровня билирубина. В случаях, когда желтуха является начальным проявлением заболевания, отмечаются более быстрое развитие терминальной стадии, уменьшение продолжительности жизни и более ранний исход в сравнении с пациентами при безжелтушном варианте течения болезни.
На ранних стадиях заболевания выявляется увеличение печени (70–80%): в большинстве случаев ее консистенция средней плотности, поверхность гладкая, а на поздних стадиях – мелкобугристая, безболезненность при пальпации. На протяжении всего периода заболевания размеры печени медленно увеличиваются, что связано с ее компенсаторной регенерацией в ответ на снижение функциональной способности гепатоцитов или на токсическое воздействие избыточных желчных кислот. Гепатомегалия, с одной стороны, свидетельствует о поражении печени, а с другой – о сохранении регенераторной способности органа.
Увеличение размеров селезенки не характерно для ПБЦ (20%) и отмечается на поздних стадиях болезни, при развитии портальной гипертензии.
Клиническая картина может определяться осложнениями и сопутствующими заболеваниями. Так, при ПБЦ снижается секреция желчных кислот, что приводит к появлению стеатореи с потерей жира с фекалиями (более 7 г в сутки), недостаточному всасыванию в тонкой кишке ионов кальция и жирорастворимого витамина D, постепенному развитию остеодистрофии. На ранних стадиях ПБЦ остеодистрофия проявляется болями в костях, при тяжелом течении развивается остеопороз. Наблюдаются патологические переломы преимущественно позвонков и ребер, реже – костей таза и длинных трубчатых костей. Выраженность остеопороза зависит от физической активности, питания, гормонального статуса, генетических факторов (ген рецептора витамина D).
Кожный зуд, сопровождающийся нарушением сна, а также ухудшение процессов всасывания жиров и жирорастворимых витаминов способствуют медленно прогрессирующему похуданию. При дефиците витамина К развивается коагулопатия, витамина А – нарушение зрения.
Появление конкрементов желчного пузыря осложняет течение ПБЦ в 35–40% случаев. При этом, как правило, образуются пигментные конкременты.
Нередко у данных пациентов встречаются различные внепеченочные заболевания иммунной природы, которые затрудняют диагностику ПБЦ. К ним относятся: синдром Шегрена, аутоиммунный тиреоидит, ревматоидный артрит, синдром Рейно, склеродермия, почечный тубулярный ацидоз, фиброз легких, полимиозит, CREST-синдром (С – кальциноз кожи, R – синдром Рейно, E – эзофагит с нарушением моторики, S – склеродактилия, T – телеангиэктазии), саркоидоз, гемолитическая анемия, целиакия, воспалительные заболевания кишечника.
Течение ПБЦ
Исходя из начальных признаков и клинического течения заболевания предложено несколько классификаций его клинических стадий. Так, H. Sasaki и соавт. [18], при классическом течении ПБЦ выделяют четыре стадии: бессимптомную, стадию кожного зуда, стадию желтухи, терминальную.
По-видимому, ПБЦ предшествует длительный бессимптомный период и/или его течение маскируется проявлениями других заболеваний. В этот период обычно отсутствуют какие-либо физикальные признаки болезни, а в крови пациентов обнаруживают АМА. При биохимическом анализе крови выявляется умеренное повышение активности гамма—глутамилтранспептидазы (ГГТП), щелочной фосфатазы (ЩФ), лейцинаминопептидазы (ЛАП) и 5′—нуклеотидазы (5′-НК). Содержание сывороточного холестерола и активность аминотрансфераз в этот период соответствуют норме. Морфологическое исследование гепатобиоптата позволяет диагностировать одну из стадий ПБЦ. Прогрессирующая фибротическая перестройка печени в поздние стадии заболевания приводит к развитию портальной гипертензии с ее осложнениями, а именно – варикозному расширению вен пищевода, асциту, печеночной энцефалопатии и др. Продолжительность жизни у больных, не получающих лечения, 10–15 лет [11].
Гепатоцеллюлярная карцинома при ПБЦ наблюдается редко [19, 20].
Длительный период наблюдения и анализ клинико-биохимической и морфологической картины пациентов с ПБЦ позволил нам выделить следующие варианты его течения [21]:
• АМА-позитивный (классический) вариант (85,4%). Характеризуется типичными клиническими проявлениями – кожным зудом, желтухой, наличием биохимических признаков холестаза и выявлением в сыворотке крови АМА в диагностическом титре (более 1:40);
• АМА-негативный вариант (14,6%). Отличается меньшей биохимической и иммунологической активностью, более низкой частотой внепеченочных проявлений, что не влияет на прогноз и сроки прогрессирования ЦП;
• перекрестный синдром (overlap-syndrome) с аутоиммунным гепатитом (АИГ) – ПБЦ/АИГ (9,4%). Присутствуют одновременно признаки ПБЦ и АИГ (признаки холестаза и цитолиза, наличие аутоантител – антимитохондриальных, антинуклеарных, антигладкомышечных, в гепатобиоптате – морфологические признаки негнойного деструктивного холангита, мостовидные некрозы, плазматические клетки);
• бессимптомное течение (10,9%). Характеризуется отсутствием клинических проявлений ПБЦ в течение длительного периода, манифестацией заболевания на стадии осложнений ЦП (кровотечение из варикозно-расширенных вен пищевода, асцит и пр.). У части пациентов (8,6%) может отсутствовать кожный зуд.
Благодаря внедрению в клиническую практику метода определения АМА в сыворотке крови стала доступной ранняя диагностика заболевания на стадии негнойного деструктивного холангита, а не билиарного цирроза [22, 23].
Диагностика ПБЦ
Хронический холестаз – это нарушение синтеза и оттока желчи, которое наблюдается более 6 мес. При этом увеличение активности ЩФ продолжительностью более 6 мес и наличие АМА в титре, превышающем 1:40, позволяют предположить ПБЦ, морфологические изменения которого на ранней стадии заболевания соответствуют негнойному деструктивному холангиту [24].
АМА-позитивные пациенты с нормальным уровнем ЩФ имеют высокий риск развития ПБЦ в течение жизни. Установлена высокая частота обнаружения АМА среди родственников I линии, особенно у лиц женского пола (20,7% – сестры, 15,1% – матери, 9,8% – дочери) [25].
Нередко отмечается сочетанное увеличение активности ЩФ и ГГТП. Однако изолированное повышение уровня ГГТП не является высокоспецифичным для ПБЦ и может быть обусловлено влиянием алкоголя или лекарственных препаратов. Как и изолированное повышение активности ЩФ, оно может быть следствием изменений костной ткани, беременности, внутрисемейного холестаза и др.
Необходимость проведения диагностического поиска и исключения ПБЦ рассматривается при увеличении активности ЩФ в 1,5 раза от верхней границы нормы (ВГН) и ГГТП – более чем в 3 раза [1].
Биохимические тесты не позволяют различить внутри и внепеченочный холестаз. Для оценки состояния внутри и внепеченочных желчных протоков проводится ультразвуковое исследование (УЗИ) органов брюшной полости, магнитно—резонансная холангиопанкреатография (МРХПГ), эндоскопическая сонография (ЭСГ), эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ) со сфинктеропапиллотомией, применяемой с целью улучшения оттока желчи. ЭРХПГ особенно важна при проведении дифференциальной диагностики с первичным склерозирующим холангитом (ПСХ).
Существенное преимущество в трактовке состояния билиарной системы принадлежит МРХПГ и ЭСГ, поскольку ЭРХПГ, прежде всего при проведении сфинктеропапиллотомии, может вызвать панкреатит (3–5%), кровотечение (2%), холангит (1%). Летальность при этом пособии составляет 0,4% [26].
Постановка диагноза на ранних стадиях ПБЦ не представляет больших затруднений особенно если при обследовании у женщины средних лет выявляются клинические проявления классического течения заболевания.
Морфологические изменения при ПБЦ характеризуются своеобразной «мозаичностью» повреждений и стереотипностью реакций ткани печени. Это связано с тем, что последовательное прогрессирование от одной стадии к другой может быть выражено в различных участках органа. Несмотря на это, по данным G. Kloppel и соавт., пункционная биопсия в большинстве случаев позволяет выявить признаки, характеризующие ту или иную стадию ПБЦ [27].
В другом исследовании при сопоставлении у 252 пациентов уровней аминотрансфераз и билирубина со степенью лимфоидно-клеточной инфильтрации, фиброза и стеатоза установлено, что характер гистопатологических изменений не может заменить биопсию печени в оценке выраженности морфологических изменений [28].
Все же следует подчеркнуть, что гистологическая картина более показательна на ранних стадиях ПБЦ, чем при наличии развернутой картины ЦП. Как правило, формируется микронодулярный ЦП и часто бывает трудно, а иногда невозможно отличить ПБЦ от других этиологических форм цирроза. Поэтому проведение биопсии печени показано, когда при типичной картине заболевания отсутствуют сывороточные АМА либо в случаях, требующих установления стадии и активности заболевания, а также при предположении о наличии «перекрестного» синдрома [13].
Лапароскопия позволяет уточнить наличие IV стадии ПБЦ (фиброз IV).
Лабораторные признаки ПБЦ
Внутрипеченочный холестаз при ПБЦ – многофакторный процесс, который приводит к биохимическим нарушениям и повреждению субклеточных структур с изменением метаболизма желчных кислот (ЖК) и их трансмембраного транспорта, который осуществляется белками-переносчиками в синусоидальной и каналикулярной мембранах.
Для ПБЦ характерны изменения многих биохимических показателей. В сыворотке крови пациентов выявляются увеличение активности ЩФ, ГГТП, ЛАП, 5′-НК, повышенное содержание билирубина, ЖК, холестерола, фосфолипидов, меди, γ-глобулинов, а также снижение уровня общего белка преимущественно за счет фракции альбуминов.
Кроме того, при ПБЦ – хроническом холестатическом заболевании печени аутоиммунного генеза – наблюдаются изменения различных иммунных показателей (повышение содержания иммуноглобулинов класса М, появление и нарастание титра аутологичных антител, иммунных комплексов и др.).
Повышение активности ЩФ, ГГТП, 5′-НК
Изменение содержания холестерола и фосфолипидов в крови больных ПБЦ, по-видимому, связано с регургитацией билиарного холестерола и лецитина в кровоток и их повышенным синтезом в печени. Основу биосинтеза фосфолипидов составляет ортофосфат, образование которого зависит от активности гидролаз – ЩФ и 5′-НК, участвующих в гидролизе фосфомоноэфиров с образованием ортофосфата. При этом под влиянием 5′-НК осуществляется гидролиз рибонуклеотидов АМФ, ГМФ, ЦМФ и УМФ до рибонуклеозидов (аденозин, гуанозин, цимитидин, уридин) и ортофосфата. Активность ЛАП повышается, в частности, при повреждении эпителия желчных протоков.
ЩФ активирует гидролиз глицерофосфата, глюкозо-1-фосфата и глюкозо-6-фосфата с образованием соответствующих углеводов и неорганического фосфата. Следует подчеркнуть, что при ПБЦ отмечено увеличение активности преимущественно печеночной фракции фермента – одной из двух изоформ ЩФ (по месту биосинтеза выделяют печеночную и костную изоформы).
Повышение активности ЩФ и 5′-НК при ПБЦ, вероятно, связано и с увеличением их биосинтеза из аминокислот, доставляемых в клетку при участии ГГТП. У некоторых пациентов наблюдается раннее увеличение активности ГГТП (более чем в 3 раза от ВГН), предшествующее повышению активности ЩФ. При исключении влияния алкоголя или лекарственных препаратов этот тест является весьма чувствительным для выявления холестаза у больных ПБЦ.
В период формирования заболевания активность аминотрансфераз сыворотки крови в отличие от ГГТП, ЩФ и 5′-НК длительное время не превышает ВГН или увеличивается незначительно, что свидетельствует о сохранной проницаемости цитоплазматической мембраны гепатоцитов.
В клинической практике наиболее распространено определение у пациентов с ПБЦ активности ЩФ и ГГТП.
Гипербилирубинемия
В крови больных ПБЦ отмечается повышение уровня многих составных компонентов желчи. При этом конъюгация билирубина и желчных кислот в гепатоцитах остается сохранной, а процесс их экскреции нарушается. Содержание общего билирубина на стадии клинически выраженной симптоматики заболевания редко достигает очень высоких цифр. Конъюгированный билирубин может также определяться в моче. При этом уробилиноген экскретируется с мочой пропорционально количеству желчи, поступающей в двенадцатиперстную кишку. Однако повышение концентрации билирубина до 2 ВГН в начальной стадии заболевания в отсутствие клинических проявлений не характерно для ПБЦ и требует продолжения диагностического поиска других причин возникновения гипербилирубинемии. Напротив, прогрессирующее повышение уровня билирубина при ПБЦ является основным прогностическим фактором.
Увеличение содержания билирубина и появление желтухи может быть обусловлено рядом причин. Так, при повышенном распаде гемма в крови начинают преобладать неконъюгированные формы билирубина, а при нарушении поступления последнего из гепатоцита в просвет желчного капилляра или наличии рефлюкса желчи из желчного капилляра в пространство Диссе, а затем в кровь – конъюгированные (связанные) формы (при условии сохранности нормальной активности гликозилирующих ферментов).
Повышение уровня билирубина при ПБЦ происходит в основном за счет конъюгированной фракции. Эти данные свидетельствуют о том, что развитие гипербилирубинемии у таких больных скорее всего вызвано рефлюксом желчи из просвета желчного капилляра или из гепатоцита в кровь. У пациентов с ПБЦ отмечаются выраженные индивидуальные колебания показателей билирубина. Однако в целом его содержание соответствует стадии заболевания и степени активности патологического процесса.
У больных ПБЦ при биохимическом исследовании сыворотки крови наряду с повышением уровня билирубина и желчных кислот выявляется повышенное содержание общих липидов, преимущественно за счет холестерола и фосфолипидов, и, как следствие, образуются отложения холестерола и его производных в виде ксантом и ксантелазм. Уровень нейтральных липидов крови при холестазе практически не изменяется.
Повышенное содержание холестерола и липидов при ПБЦ, очевидно, связано с нейтрализацией детергентного действия избыточных ЖК.
Изменения в метаболизме меди
Как известно, печень играет важную роль в метаболизме меди за счет образования в гепатоцитах комплексов белок–медь и экскреции ее с желчью. В норме около 80% поступающей в организм меди экскретируется в желчь и выделяется с фекалиями.
При всех формах холестаза, в том числе при ПБЦ, происходит накопление меди в печени, иногда до уровня, встречающегося при болезни Вильсона. Содержание ее может превысить более 25 мг на 100 г сухого веса ткани печени (при норме до 6 мг на 100 г). При этом отсутствуют клинические признаки токсического воздействия меди на организм человека, а также не выявляется кольцо Kayser–Fleischer. Это свидетельствует о том, что медь, накапливаемая в организме, не обладает токсическими свойствами, что, скорее всего, обусловлено связыванием ее протеинами. При холестазе у пациентов с ПБЦ медь накапливается в гепатоцитах в нетоксической форме.
Снижение белково-синтетической функции
Содержание альбуминов и глобулинов в крови больных ПБЦ на ранних стадиях находится в пределах нормы. По мере прогрессирования заболевания наблюдается повышение уровня γ-глобулинов, особенно IgM. При этом одновременно уменьшается количество альбумина в крови, что указывает на нарушение белково-синтетической функции гепатоцитов. Наиболее выраженные изменения этих биохимических показателей выявляют, как правило, на далеко зашедшей стадии с развитием цирроза.
Иммунологические признаки ПБЦ
Активность антител к антигенам различной специфичности (экзогенной и аутологичной природы) связана с различными классами иммуноглобулинов – A, D, E, G, M. При ПБЦ отмечается максимальное повышение концентрации IgM. Появление антител класса IgM – самая ранняя ответная реакция иммунной системы на антиген. Содержание IgM при ПБЦ достигает в среднем 6,27±0,66 г/л [29].
Образование иммунных комплексов больших размеров, активирующих систему комплемента, может приводить к деструкции эпителия желчных канальцев, образованию гранулем [30].
У пациентов с классическим течением ПБЦ в крови обнаруживаются антитела к антигенам митохондрий. В сыворотке крови больных ПБЦ АМА впервые были найдены J.G. Walker и соавт. [31]. В настоящее время они служат маркёрами внутрипеченочного холестаза.
АМА не являются строго специфичными для ПБЦ. К их семейству относят 9 типов антител (М1–М9). С помощью метода непрямой иммунофлуоресценции АМА выявляются у пациентов с лекарственным гепатитом, хроническим активным гепатитом, системной красной волчанкой, кардиомиопатией, сифилисом и другими заболеваниями [32].
Кроме того, антитела M2, M4, M8, M9 объединены в четыре типа (А–D), поскольку они нередко обнаруживаются при ПБЦ. Чувствительность выявления изолированных антител или их комбинации составляет 66–96%.
Высокочувствительными для ПБЦ являются АМА М2 к протеинам ПДГ-комплекса. Антигенные компоненты М2 локализуются на внутренней мембране митохондрий [33, 34] и выявляются методом ELISA c применением специфических антигенов.
C помощью иммуноблотинга были идентифицированы 4 полипептида ПДГ (ПДГ-Е2, ПДГ-E1α, ПДГ-E1β и протеин Х). Они представляют собой семейство оксигеназных комплексов для 2-оксокислот, включая Е2 единицу ПДГ, дегидрогеназный комплекс для 2-оксокислот с разветвленной цепью, дегидрогеназный комплекс для кетоглутарата и дигидролипоамидный дегидрогеназа-связывающий белок [35]. Помимо этого, между ними существует значительное сходство: они содержат липоевую кислоту, участвуют в окислительном фосфорилировании. Причем для метаболизма пирувата также необходима липоевая кислота.
Наиболее часто (95%) у пациентов с ПБЦ встречаются аутоантитела к антигенам ПДГ-Е2. ПДГ-Е2 представляет собой большую многомерную структуру, состоящую примерно из 60 элементов, связанных между собой. Ее размеры превышают размер рибосомы [36].
ПБЦ является единственным заболеванием, при котором выявляются Т-клетки, реагирующие с ПДГ-Е2, что имеет существенное значение в патогенезе этого заболевания [37–39]. Например, аминокислоты ПДГ-Е2 в положении 163–176 являются эпитопом для Т-лимфоцитов. Этот участок располагается в области липоиловых элементов, где с молекулой ПДГ-Е2 взаимодействуют аутоантитела.
Важная роль в осуществлении этих реакций принадлежит аминокислоте лизин, связывающей липоевую кислоту. Последняя имеет дисульфидную связь, которая легко может быть разрушена, поскольку располагается на поверхности молекулы.
Таким образом, липоиловые элементы и липоевая кислота являются необходимыми звеньями в развитии иммунного ответа на ранних стадиях ПБЦ. Возможно, нарушение метаболизма лизин–липоата в этих митохондриальных антигенах служит важнейшим механизмом, обусловливающим развитие аутоиммунной реакции, приводящей к деструкции и апоптозу эпителия желчных протоков.
АМА могут обнаруживаться до появления клинической симптоматики и морфологических изменений. Однако корреляционная связь между титром антител и выраженностью повреждения эпителия желчных протоков отсутствует. Определение АМА прежде всего имеет диагностическое значение.
Почти у половины больных ПБЦ обнаруживаются антинуклеарные антитела (АНА), относящиеся в основном к IgG. Нередко АНА выявляются у пациентов, не имеющих АМА. Прогноз у больных ПБЦ с высокой концентрацией АНА в крови наименее благоприятен.
Антитела к сократительным белкам гладкой мускулатуры (АГМ) встречаются реже, чем антинуклеарные. Примерно у одной трети больных эти антитела обнаруживаются одновременно с АНА. АГМ не обладают органной и видовой специфичностью, аутоантигеном для них служит F-актин. АГМ при ПБЦ относятся в основном к IgM.
Реже встречаются, но обладают большей специфичностью для ПБЦ антитела к белкам оболочки ядра (антитела к gp-210, к нуклеопорину р62, к sp100, к ламиновому В-рецептору, антициклин А). Наиболее часто антитела формируют кольцо вокруг ядра, а также множество пятен, сформированных аутоантителами к GP210 и нуклеопорину 62 в области нуклеопор, а также к ядерному белку sp100 [40].
А. Granito и соавт. [41] разработали метод определения антител к новому протеину ядра (sp140). При этом частота его регистрации у больных ПБЦ составила 90% (19/20).
Обнаружение этих антител важно в диагностическом и прогностическом плане. Выявление антител против антигенов оболочки ядра при наличии клинических признаков заболевания, но при отсутствии АМА позволяет подтвердить диагноз и свидетельствует о неблагоприятном течении ПБЦ [13].
Морфологические признаки ПБЦ
Различают 4 стадии заболевания. Данные биопсии печени для ПБЦ имеют ограниченное клиническое значение, поскольку у пациента в гепатобиоптате могут наблюдаться одновременно все стадии заболевания [10, 42].
Согласно морфологической классификации, различают следующие стадии ПБЦ [43]:
• негнойный деструктивный холангит;
• пролиферация желчных канальцев и перидуктальный фиброз;
• формирование рубцов;
• истинный ЦП.
При I–II стадиях ПБЦ в биоптатах обнаруживают различные фазы повреждения желчных канальцев. По данным G. Roschlau [44], эти изменения могут предшествовать клиническим проявлениям болезни. Начальные повреждения развиваются в междольковых протоках диаметром 45–75 мкм. Самой ранней следует считать дистрофию клеток эпителия протоков. Цитоплазма их становится зернистой или гомогенной эозинофильной, набухшей, вакуолизированной, ядра пикнотичными. В дальнейшем развивается некроз небольшого сегмента канальца, но контуры его еще сохраняются и, наконец, стенка разрушается – формируется картина деструктивного холангита.
В перипортальных полях вокруг эпителия, выстилающего желчные протоки, наблюдается лимфоидно-плазмоклеточная инфильтрация. При этом эпителиальные клетки выглядят сдавленными, особенно в базальной части. При исследовании воспалительных инфильтратов отмечается повышенное содержание CD4-лимфоцитов, превышающее количество CD8-лимфоцитов (4:1).
Встречаются также крупные лимфатические фолликулы, обильная инфильтрация портальных трактов, иногда с примесью ксантомных клеток, видны отдельные гистиоцитарные и эпителиальноклеточные гранулемы.
Поражение септальных или междольковых желчных протоков является патогномоничным признаком ПБЦ, но в материале пункционных биопсий такие изменения находят нечасто [45]. Гепатоциты в этой стадии имеют обычное строение, звездчатые ретикулоэндотелиоциты гиперплазированы.
При II–III стадиях ПБЦ преобладают пролиферация дуктул, проникающих за пограничную пластинку, перидуктальный фиброз и процессы склерозирования с образованием слепых септ.
Фиброз портальных полей может привести к развитию портальной гипертензии еще задолго до формирования ЦП. Эпителий части пролиферирующих канальцев дистрофически изменен. Это можно расценить как наличие признаков обострения или проградиентного течения. Желчные протоки выявляются не во всех портальных трактах. На их месте располагаются рубцы или небольшие группы эпителиальных клеток. Желчные тромбы встречаются редко. Структура паренхимы обычно сохранена. На месте разрушенных гепатоцитов в печеночной дольке определяются лобулярные некрозы.
Для IV стадии ПБЦ характерна картина выраженного микронодулярного цирроза. Наряду с этим можно наблюдать и признаки, свойственные более ранним стадиям, в том числе гранулемы. Воспалительная инфильтрация обнаруживается преимущественно вокруг последних оставшихся желчных протоков и исчезает после их разрушения. Распознать развившийся цирроз у пациентов с ПБЦ часто бывает трудно, а иногда и невозможно отличить от ЦП другого происхождения.
Таким образом, лишь последняя стадия ПБЦ соответствует общепринятым критериям цирроза. В остальных отсутствуют диффузный фиброз, узловая трансформация – необходимые признаки ЦП, вытекающие из его определения. В формировании финальной стадии цирроза большое значение придается ступенчатым и мостовидным некрозам паренхимы [30]. Для оценки фиброза при ПБЦ в клинической практике предложены 4 стадии фиброзирования [46]:
• отсутствие фиброза (I стадия);
• перипортальный фиброз (II стадия);
• мостовидный фиброз (III стадия);
• цирроз (IV стадия).
Дифференциальный диагноз
4–6 нед).
Этиология заболеваний печени, протекающих с холестазом, вызванным экзогенными факторами, устанавливается благодаря тщательному сбору анамнеза у пациента и/или у окружающих его лиц, при развитии вирусного гепатита – путем определения серологических маркёров вирусов гепатитов В, С и D.
При проведении дифференциальной диагностики между ПБЦ и ПСХ имеют значение пол больного, наличие или отсутствие АМА и других аутоантител, наиболее часто перинуклеарных антител к цитоплазматическим антигенам нейтрофилов (pANCA) – perinuclear antineutrophilic cytoplasmic antibody, а также данные ЭРХПГ или МРХПГ. Для ПСХ характерно либо отсутствие, либо низкие титры АМА. Чаще им страдают мужчины молодого или среднего возраста.
В ходе ЭРХПГ и МРХПГ у больных ПСХ отмечаются нарушение типичной структуры желчных протоков в виде неравномерности просвета общего желчного протока, деформации вне и внутрипеченочных желчных протоков и появление участков четкообразных неровностей за счет чередования стенозирования и мешковидных расширений.
При развернутой стадии ПБЦ нередко вызывает затруднение разграничение с АИГ. Для постановки диагноза АИГ предложены «упрощенные» критерии выявления этого заболевания: наличие в сыворотке крови либо АНА, АГМ (1:80 и более), либо антител к растворимому антигену печени (SLA), либо аутоантител к микросомальному антигену печени и почек (LKM – liver kidney microsomal antibodies в титре ≥ 1:40); повышение уровня IgG более 1,1 ВГН; морфологические изменения ткани печени, соответствующие хроническому гепатиту; отсутствие маркёров вирусов гепатитов [48].
Кроме того, для ПБЦ характерно более высокое содержание IgM в сравнении с уровнем IgG, что позволяет также дифференцировать ПБЦ и АИГ [49, 50].
В случаях когда у пациента с ПБЦ в диагностическом титре выявляют АНА, АГМ, следует обсуждать диагноз ПБЦ/АИГ, т. е. «перекрестный синдром». При гистологическом исследовании обнаруживаются признаки двух заболеваний – поражение внутрипеченочных желчных протоков, лимфоцитарно-плазмоклеточные инфильтраты, мостовидные некрозы гепатоцитов и др.
Данная патология в группе больных с хроническими заболеваниями печени аутоиммунного генеза не является редкой. А. Heurgué и соавт. [51] при ретроспективном анализе клинических, биохимических и гистологических показателей 115 пациентов с ПБЦ и АИГ, наблюдавшихся в пяти различных центрах за период 1984–2005 гг., в 13,9% случаев диагностировали «перекрестный» синдром.
Таким образом, ПБЦ – хроническое прогрессирующее заболевание печени аутоиммунного генеза, клиническая картина которого характеризуется синдромом холестаза, развившегося вследствие структурных изменений эпителия внутрипеченочных желчных протоков. Выявление АМА М2 в клинической практике позволяет диагностировать эту патологию уже на ранних стадиях заболевания.
Дальнейшее совершенствование иммунологических методов обнаружения аутоантител (в частности, к протеинам и эпителию желчных протоков) дает возможность оптимизировать диагностический поиск при холестатических поражениях печени, протекающих в отсутствие АМА, при далеко зашедшей стадии ЦП и при поражениях желчных протоков неясной природы.
Современная терапия ПБЦ
В настоящее время во всем мире для лечения пациентов с ПБЦ используется препарат Урсофальк (урсодезоксихолевая кислота – УДХК) в дозе 13–15 мг/кг/сут. Урсофальк – гидрофильная, нетоксичная, третичная желчная кислота.
Прошло более ста лет со дня открытия лечебных свойств урсокислот. Однако на сегодняшний день не все механизмы УДХК раскрыты. Накоплено значительное число данных экспериментальных и клинических исследований, доказывающих антиапоптотический, цитопротективный, антифибротический, иммуномодулирующий, холеретический, холелитический, антипролиферативный механизмы действия.
В последних исследованиях показано влияние УДХК на активность белков холеретического транспорта (MRP2, BSEP), что обеспечивает увеличение экспрессии желчных кислот с желчью, повышение поступления солей ЖК в систему энтерогепатической циркуляции, активацию внутриклеточных сигнальных молекул.
Урсофальк является препаратом первой линии при ПБЦ. Его применение способствует значительному уменьшению интенсивности кожного зуда (или его полному купированию), улучшению или нормализации биохимических показателей печени и гистологической картины, замедлению прогрессирования фиброза и цирроза печени, а также снижению портальной гипертензии. Это единственный препарат, длительное применение которого позволяет отсрочить или даже избежать трансплантации печени, достоверно увеличить качество и продолжительность жизни пациентов с ПБЦ [52–54].
Урсофальк безопасен и имеет небольшое количество нежелательных реакций. Редко у некоторых больных отмечаются диарея, метеоризм, выпадение волос.
Вместе с тем в ряде клинических наблюдений даже на фоне терапии с использованием УДХК не всегда удается полностью достичь клиникобиохимической ремиссии и остановить прогрессирование заболевания. Для усиления терапевтического эффекта УДХК при ПБЦ было предложено применение топического синтетического глюкокортикостероида 2-го поколения – препарата буденосид. При прохождении через печень 90% буденосида разрушается, а 90% из поступающего в системный кровоток количества связывается с альбумином и инактивируется (системная биодоступность препарата составляет около 1%). Будесонид обладает выраженной аффинностью к стероидным рецепторам (в 60 раз выше, чем у преднизолона), что обусловливает значительно более высокую активность этого препарата по сравнению с представителями системных кортикостероидов.
Результаты двухлетнего проспективного плацебоконтролируемого исследования сравнительной эффективности комбинированной терапии ПБЦ будесонидом (9 мг/сут) и УДХК (15 мг/кг/сут) и монотерапии УДХК (15 мг/кг/сут) продемонстрировали существенное улучшение лабораторных и гистологических показателей при включении будесонида в лечение данной категории больных [55].
В последующие годы была показана безопасность и хорошая переносимость будесонида в комбинированной терапии с назначением УДХК при ПБЦ на стадии хронического гепатита [56].
Побочные эффекты будесонида выражены нерезко. Однако при применении препарата на стадии цирроза печени отмечены нежелательные проявления вследствие наличия портосистемного шунтирования, сопоставимые с таковыми при использовании традиционных кортикостероидов.