Что содержит актин и миозин
Мышечные ткани
Общими свойствами всех мышечных тканей является сократимость и возбудимость. К данной группе тканей относятся гладкая, поперечнополосатая скелетная и поперечнополосатая сердечная мышечные ткани. Клетки мышечной ткани имеют хорошо развитый цитоскелет, содержат много митохондрий.
Гладкая (висцеральная) мускулатура
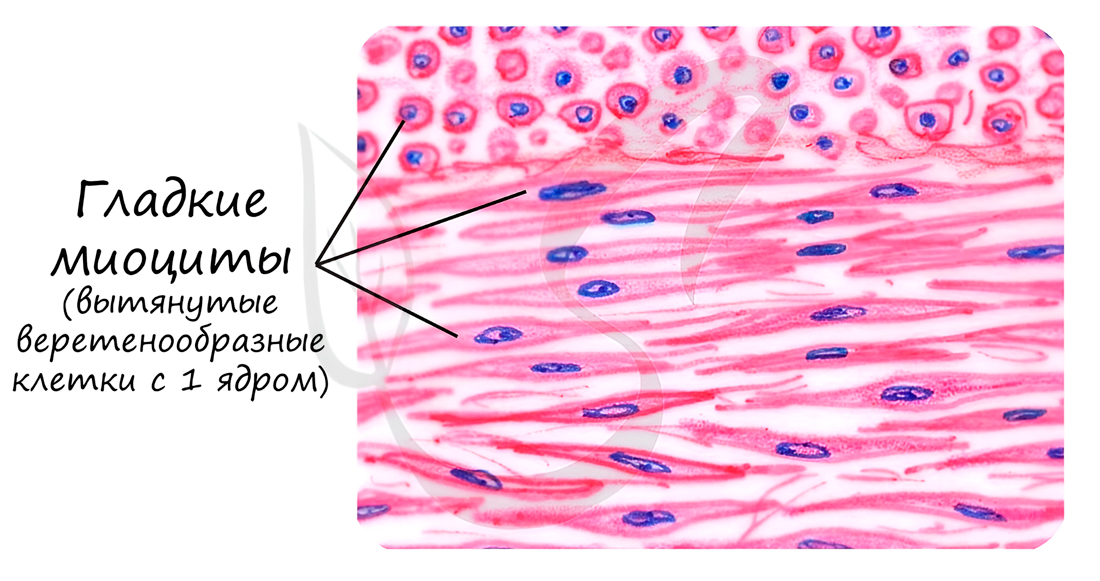
Эта мышечная ткань встречается в стенках внутренних органах (бронхи, кишечник, желудок, мочевой пузырь), в стенках сосудов, протоках желез. Эволюционно является наиболее древним видом мускулатуры.
Особо заметим, что в гладкой мышечной ткани миофиламенты собираются в миофибриллы только во время сокращения. У таких временных миофибрилл не может быть регулярной организации, а значит ни у таких миофибрилл, ни у гладких миоцитов не может быть поперечной исчерченности.
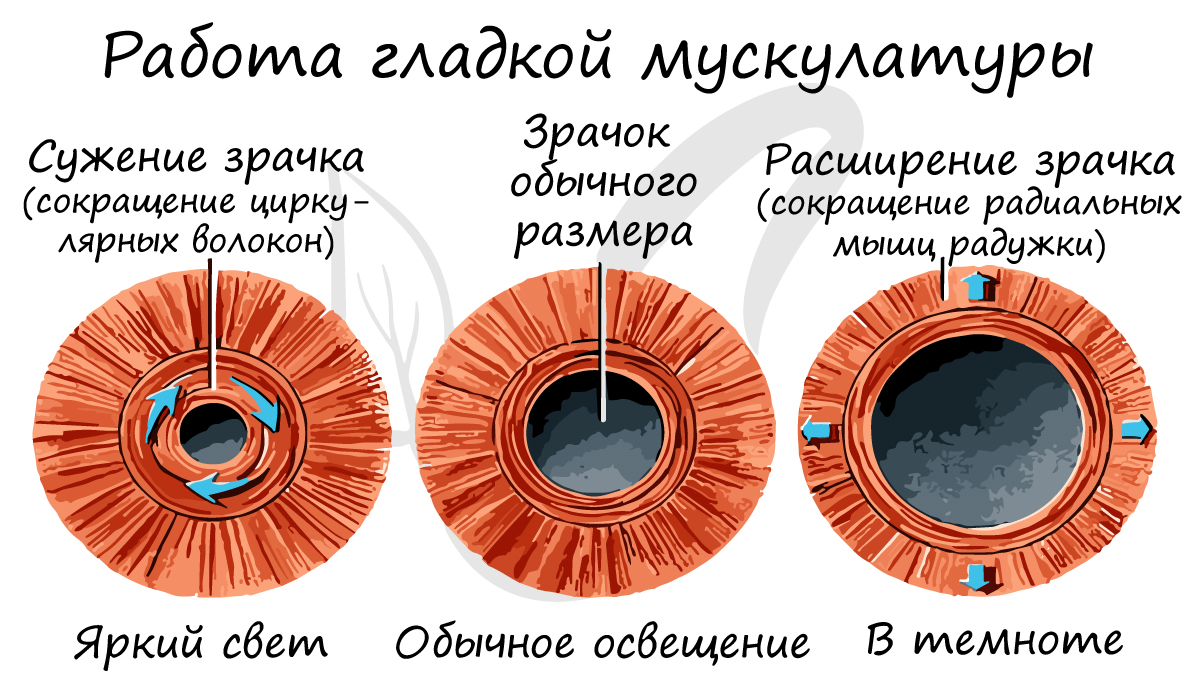
Гладкая мышечная ткань сокращается непроизвольно (неподвластна воле человека). Работа гладких мышц обеспечивается вегетативной (автономной) нервной системой. К примеру невозможно по желанию сузить или расширить бронхи, кровеносные сосуды, зрачок.
Гладкая мышечная ткань называется неисчерченной, так как не обладает поперечной исчерченностью, характерной для поперечнополосатых скелетной и сердечной мышечных тканей.
Скелетная (поперечнополосатая) мышечная ткань
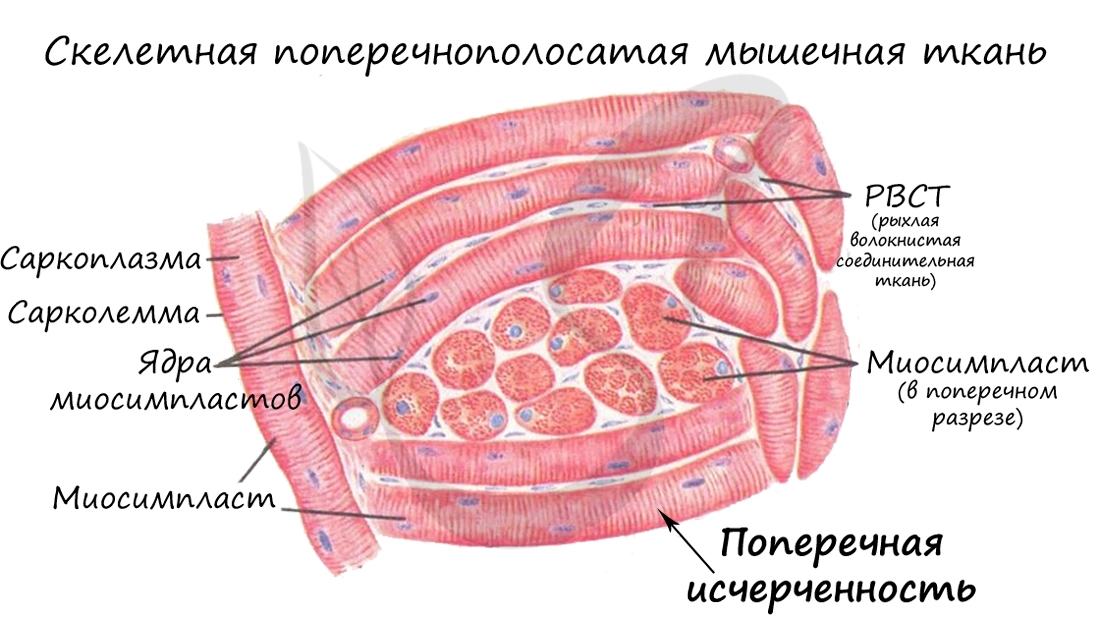
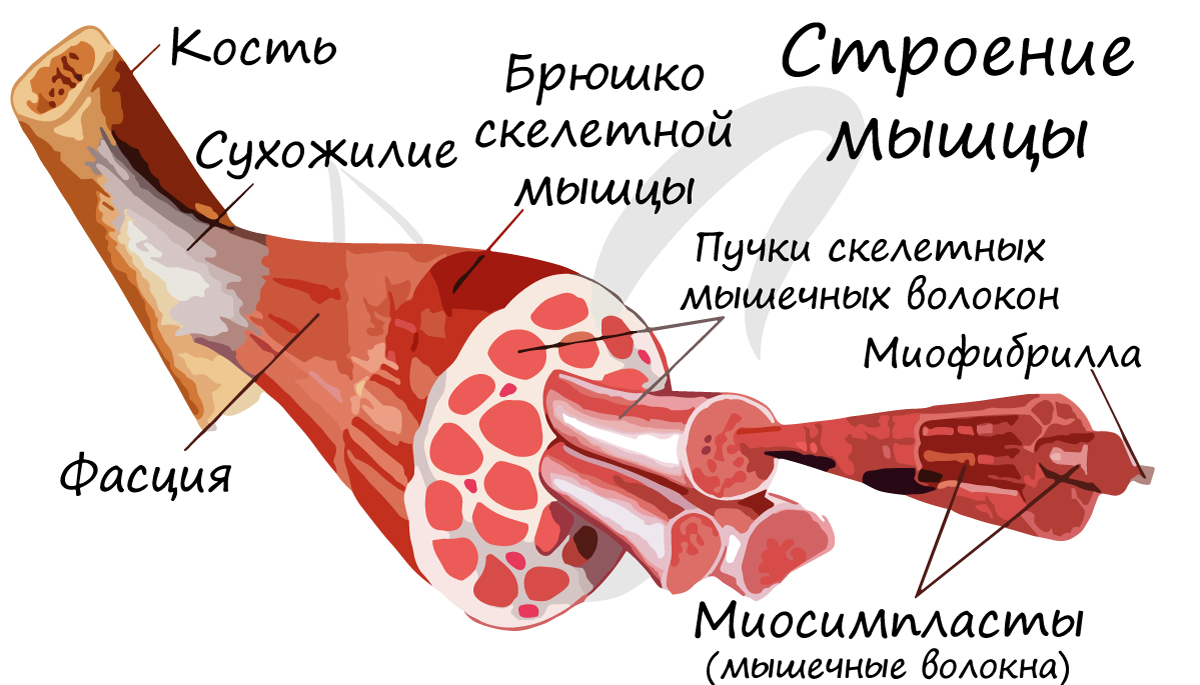
Скелетная мышечная ткань образует диафрагму (дыхательную мышцу), мускулатуру туловища, конечностей, головы, голосовых связок.
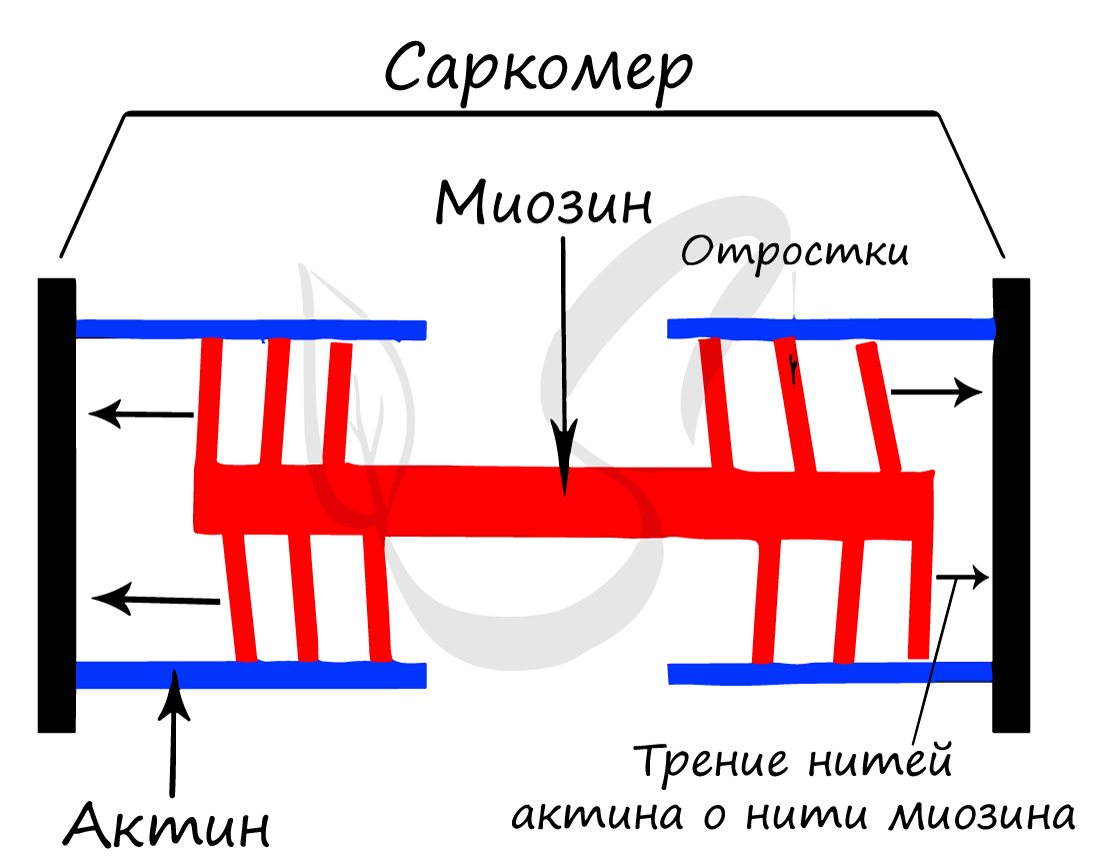
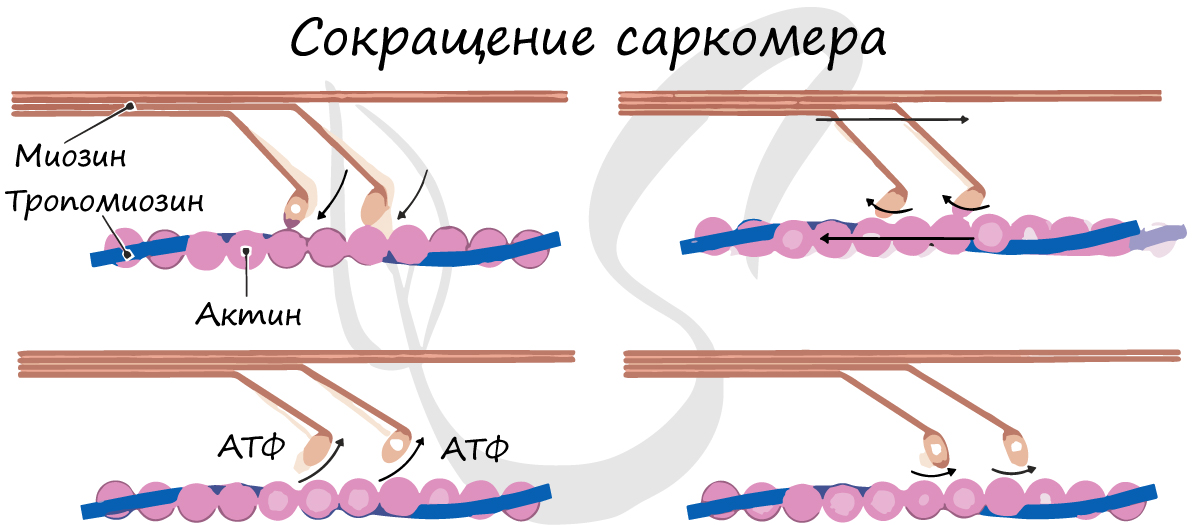
Саркомер состоит из актиновых (тонких) и миозиновых (толстых) филаментов, которые образованы главным образом белками актином и миозином. Сокращение происходит за счет взаимного перемещения миофиламентов: они тянутся навстречу друг другу, саркомер укорачивается (и мышца в целом).
Вернемся к скелетным мышцам. Имеется еще ряд важных моментов, о которых нужно знать.
Скелетные мышцы сокращаются произвольно: они подконтрольны нашему сознанию. К примеру, по желанию мы можем изменить скорость движения руки, темп бега, силу прыжка. Мышцы покрыты фасцией, крепятся к костям сухожилиями, и, сокращаясь, приводят в движение суставы.
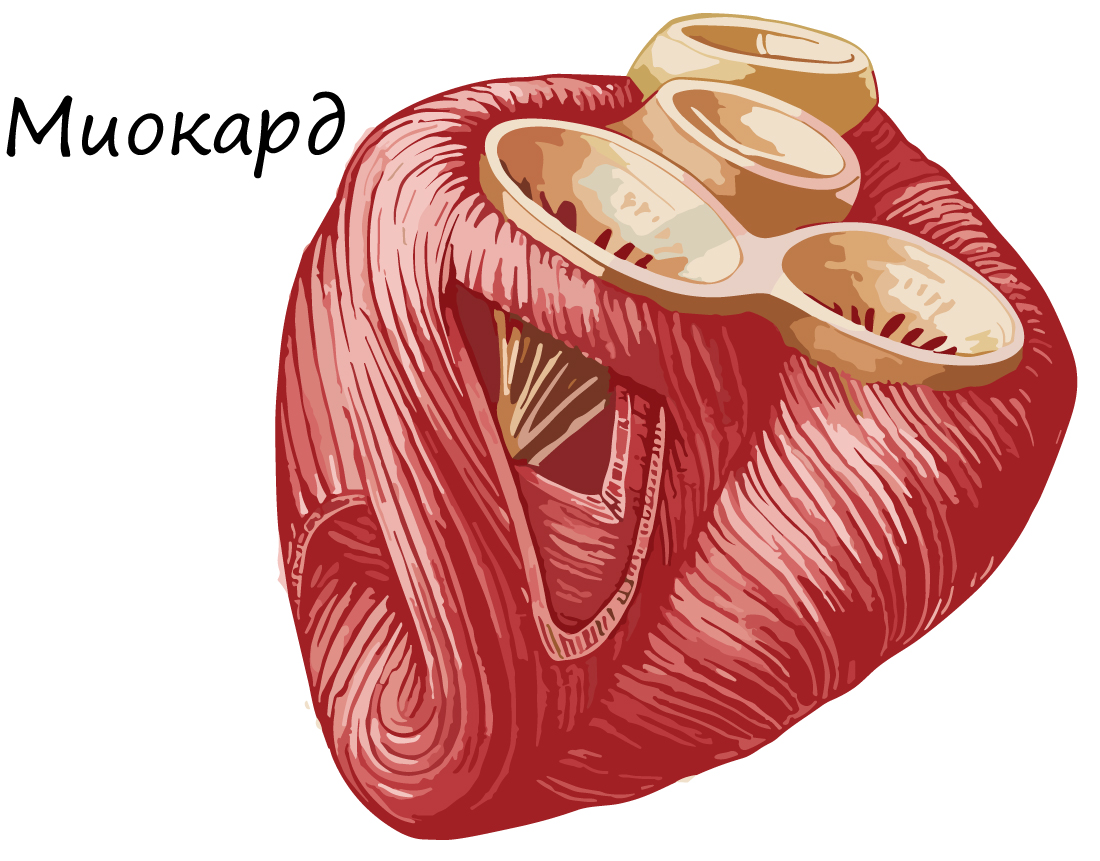
Сердечная поперечнополосатая мышечная ткань
Большое число контактов между кардиомиоцитами обеспечивает высокую эффективность и надежность проведения возбуждения по миокарду. Сокращается эта ткань непроизвольно, не утомляется.
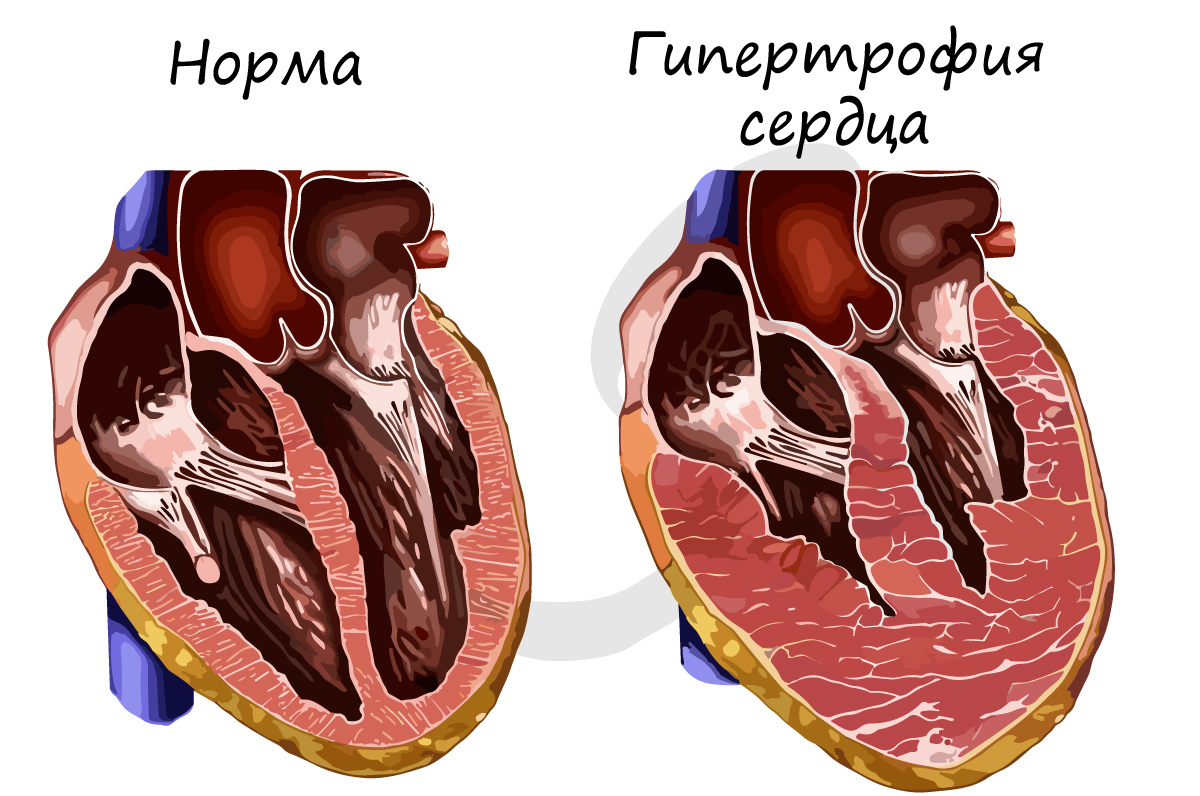
Ответ мышц на физическую нагрузку
В большинстве случае гипертрофия сердца обратима, а у спортсменов наблюдается так называемая физиологическая гипертрофия (вариант нормы).
Происхождение мышц
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Актин и миозин
| Рубрика | Химия |
| Вид | доклад |
| Язык | русский |
| Дата добавления | 22.01.2017 |
| Размер файла | 14,9 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
При электронной микроскопии видно, что на боковых сторонах миозиновой нити обнаруживаются выступы, получившие название поперечных мостиков. Они ориентированы по отношению к оси миозиновой нити под углом 120°. Согласно современным представлениям, поперечный мостик состоит из головки и шейки. Головка приобретает выраженную АТ-фазную активность при связывании с актином. Шейка обладает эластическими свойствами и представляет собой шарнирное соединение, поэтому головка поперечного мостика может поворачиваться вокруг своей оси. миозин актин биохимия
Молекула миозина состоит из двух частей: длинной палочкообразнои участка («хвоста») и присоединенной к одному из его концов глобулярной участка представлена двумя одинаковыми «головками». Молекулы миозина расположены в миозиновои нитке таким образом, что головки регулярно распределяются по всей ее длине, кроме небольшой срединной участки, где их нет («голая» зона). В тех местах, где нити актина и миозина перекрывающихся миозином головки могут прикрепляться к соседним актиновых нитей, и в результате этого взаимодействия может происходить сокращение мышцы.
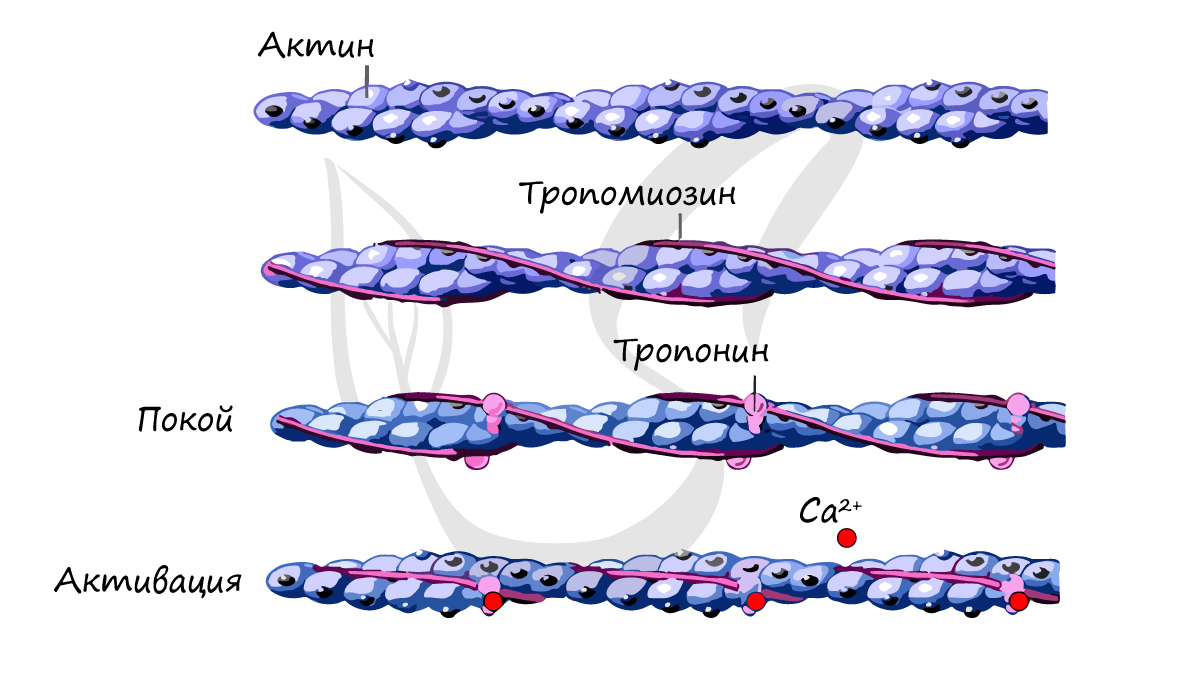
Энергия для совершения такой работы освобождается при гидролизе АТФ; все миозином головки проявляют АТФазну активность, прикрепление миозинових головок зависит от концентрации ионов Са2 + в саркоплазме. Миозиновои АТФаза активируется при взаимодействии актина с миозином. Ионы Mg2 + могут ингибировать этот процесс.
1. Г. Дюга, К. Пенни «Биоорганическая химия», М., 1983
2. Д. Мецлер «Биохимия», М., 1980
3. А. Ленинджер «Основы биохимии», М., 1985
Основные закономерности метаболических процессов в организме человека. Часть 2.
Рассматривая обмен веществ в условиях нормального функционирования организма, следует остановиться на безусловно взаимосвязанных, но в то же время достаточно специфичных составляющих метаболизма, а именно на углеводном, белковом, липидном и водно-электролитном обмене.
Очевидно, что основная роль углеводов в метаболизме определяется их энергетической функцией. Именно глюкоза крови вследствие наличия простого и быстрого пути гликолитической диссимиляции и последующего окисления в цикле трикарбоновых кислот, а также возможности максимально быстрого извлечения ее из депо гликогена, обеспечивающей экстренную мобилизацию энергетических ресурсов, является наиболее востребованным источником энергии в организме. Использование циркулирующей в плазме глюкозы разными органами неодинаково: мозг задерживает 12% глюкозы, кишечник— 9%, мышцы — 7%, почки — 5%. При этом уровень глюкозы плазмы крови является одной из важнейших гомеостатических констант организма, составляя 3, 3—5, 5 ммоль/л. Как известно снижение уровня глюкозы ниже допустимого передела имеет своим незамедлительным следствием дискоординацию деятельности ЦНС, проявляющуюся соответствующей клинической симптоматикой: головной мозг содержит небольшие резервы углеводов и нуждается в постоянном поступлении глюкозы, поскольку энергетические расходы мозга покрываются исключительно за счет углеводов. Глюкоза в тканях мозга преимущественно окисляется, а небольшая часть ее превращается в молочную кислоту.
При полном отсутствии углеводов в пище они образуются в организме из продуктов трансформации жиров и белков. В печени возможно новообразование углеводов как из собственных продуктов их распада (пировиноградной или молочной кислоты), так и из продуктов диссимиляции жиров и белков (кетокислот и аминокислот), что обозначается как глюконеогенез. В результате трансформации аминокислот образуется пировиноградная кислота, при окислении жирных кислот — ацетилкоэнзим А, который может превращаться в пировиноградную кислоту — предшественник глюкозы. Это наиболее важный общий путь биосинтеза углеводов. Между двумя основными источниками энергии — углеводами и жирами — существует тесная физиологическая взаимосвязь. Повышение содержания глюкозы в крови увеличивает биосинтез триглицеридов и уменьшает распад жиров в жировой ткани. Поступление в кровь свободных жирных кислот уменьшается. В случае возникновения гипогликемии процесс синтеза триглицеридов тормозится, ускоряется распад жиров и в кровь в большом количестве поступают свободные жирные кислоты. Гликогенез, гликогенолиз и глюконеогенез являются тесно взаимосвязанными процессами, обеспечивающими оптимальный уровень глюкозы крови сообразно степени функционального напряжения организма.
Центральным звеном регуляции углеводного и других видов обмена и местом формирования сигналов, управляющих уровнем глюкозы, является гипоталамус. Отсюда регулирующие влияния реализуются вегетативными нервами и гуморальным путем, включающим эндокринные железы. Единственным гормоном, снижающим уровень гликемии, является инсулин — гормон, вырабатываемый β-клетками островков Ланхгерганса. Снижение гликемии происходит за счет усиления инсулином синтеза гликогена в печени и мышцах и повышения потребления глюкозы тканями организма. Увеличение уровня глюкозы в крови возникает при действии нескольких гормонов. Это глюкагон, продуцируемый α-клетками островков Ланхгерганса, адреналин — гормон мозгового слоя надпочечников, глюкокортикоиды — гормоны коркового слоя надпочечников, соматотропный гормон гипофиза, тироксин и трийодтиронин — гормоны щитовидной железы. Данные гормоны в связи с однонаправленностью их влияния на углеводный обмен и функциональным антагонизмом по отношению к эффектам инсулина часто объединяют понятием «контринсулярные гормоны».
Таким образом биологическая роль углеводов для организма человека определяется прежде всего их энергетической функцией. Обладая энергетической ценностью в 16, 7 кДж (4, 0 ккал) на 1 грамм вещества, углеводы являются основным источником энергии для всех клеток организма, при этом выполняя еще пластическую и опорную функции. Суточная потребность взрослого человека в углеводах составляет около 500 г.
— пластическая (структурная) функция заключается в том, что белки являются главной составной частью всех клеточных и межклеточных структур тканей;
— ферментная (каталитическая, энзимная) функция состоит в обеспечении всех химических реакций, протекающих в ходе обмена веществ в организме (дыхание, пищеварение, выделение), деятельностью ферментов, являющихся по своей структуре белками;
— транспортная функция белков заключается в их способности к соединению с целым рядом метаболитов и переносе последних в связанном состоянии в межтканевой жидкости и плазме крови к области их утилизации;
— защитная функция белков проявляется реализацией иммунного ответа образованием иммуноглобулинов (антител) и системы комплемента при поступлении в организм чужеродного белка, а также способностью к непосредственному связыванию экзогенных токсинов; белки системы гемостаза обеспечивают свертывание крови и остановку кровотечения при повреждении кровеносных сосудов;
— регуляторная функция, направленная на сохранение гомеостаза с поддержанием биологических констатнт организма, реализуется буферными свойствами молекулы протеинов, белковой структурой клеточных рецепторов, активируемых в свою очередь регуляторными полипептидами и гормонами, также имеющими белковую структуру;
— двигательная функция, обеспечивается взаимодействием сократительных белков мышечной ткани актина и миозина;
— энергетическая роль белков состоит в обеспечении организма энергией, образующейся при диссимиляции белковых молекул; при окислении 1 г белка в среднем освобождается энергия, равная 16, 7 кДж (4, 0 ккал).
При катаболизме почти все природные аминокислоты сначала передают аминогруппу на а-кетоглутарат в реакции трансаминирования с образованием глутамата и соответствующей кетокислоты. Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогеназы, в результате чего получаются а-кетоглутарат и аммиак. При необходимости синтеза аминокислот и наличии необходимых а-кетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования а-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей а-кетокислотой, что приводит к синтезу новой аминокислоты. В случае использования белков в качестве источника энергии большинство аминокислот окисляются в конечном счёте через цикл лимонной кислоты до углекислого газа и воды. Прежде, чем эти вещества вовлекаются в заключительный этап катаболизма, их углеродный скелет превращается в двухуглеродный фрагмент в форме ацетил-КоА. Именно в этой форме большая часть молекул аминокислот включается в цикл лимонной кислоты.
Таблица 1. 1. Аминокислоты, входящие в состав белков человека.
1. Незаменимые
2. Частично заменимые
3. Условно заменимые
4. Заменимые
Таблица 1. 2. Классификация липидов организма человека.
1. Гликолипиды.
Содержат углеводный компонент.
2. Жиры.
3. Минорные липиды.
4. Стероиды.
А. Стерины (спирты).
Наиболее важен холестерин.
В. Стериды.
Эфиры стеринов и высших жирных кислот. Наиболее распространены эфиры холестерина.
5. Фосфолипипы.
Одним из продуктов катаболизма жиров, имеющем важное значения для метаболизма в целом являются кетоновые тела. Кетоновые тела — группа органических соединений, являющихся промежуточными продуктами жирового, углеводного и белкового обменов. К кетоновым телам относят β-оксимасляную и ацетоуксусную кислоты и ацетон, имеющие сходное строение и способные к взаимопревращениям. Главным путем синтеза кетоновых тел, происходящего в основном в печени, считается реакция конденсации между двумя молекулами ацетил-КоА, образовавшегося при β-окислении жирных кислот или при окислительном декарбоксилировании пирувата (пировиноградной кислоты) в процессе обмена глюкозы и ряда аминокислот. Данный путь синтеза кетоновых тел более других зависит от характера питания и в большей степени страдает при патологических нарушениях обмена веществ. Из печени кетоновые тела поступают в кровь и с нею во все остальные органы и ткани, где они включаются в универсальный энергообразующий цикл — цикл трикарбоновых кислот, в котором окисляются до углекислоты и воды. Кетоновые тела используются также для синтеза холестерина, высших жирных кислот, фосфолипидов и заменимых аминокислот. При голодании, однообразном безуглеводистом питании и при недостаточной секреции инсулина использование ацетил-КоА в цикле трикарбоновых кислот подавляется, так как все метаболически доступные ресурсы организма превращаются в глюкозу крови. В этих условиях увеличивается синтез кетоновых тел. Следует подчеркнуть важную роль кетоновых тел в поддержании энергетического баланса. Кетоновые тела – поставщики «топлива» для мышц, почек и действуют, возможно, как часть регуляторного механизма с обратной связью, предотвращая чрезвычайную мобилизацию жирных кислот из жировых депо. Печень в этом смысле является исключением, она не использует кетоновые тела в качестве энергетического материала.
Процесс образования, отложения и мобилизации из депо жира регулируется нервной и эндокринной системами, а также тканевыми механизмами и тесно связаны с углеводным обменом. Так, повышение концентрации глюкозы в крови уменьшает распад триглицеридов и активизирует их синтез. Понижение концентрации глюкозы в крови, наоборот, тормозит синтез триглицеридов и усиливает их расщепление. Таким образом, взаимосвязь жирового и углеводного обменов направлена на обеспечение энергетических потребностей организма. При избытке углеводов в пище триглицериды депонируются в жировой ткани, при нехватке углеводов происходит расщепление триглицеридов с образованием неэтерифицнрованных жирных кислот, служащих источником энергии. В обмене жиров одна из важнейших ролей принадлежит печени. Печень — основной орган, в котором происходит образование кетоновых тел (бета-оксимасляная, ацетоуксусная кислоты, ацетон), используемых как альтернативный глюкозе источник энергии.
Как указывалось выше метаболизм жиров контролируется нервной и эндокринной системами. Мобилизация жиров из депо происходит под влиянием гормонов мозгового слоя надпочечников — адреналина и норадреналина. Соматотропный гормон гипофиза также обладает жиромобилизирующим действием. Аналогично действует тироксин — гормон щитовидной железы. Тормозят мобилизацию жира глюкокортикоиды — гормоны коркового слоя надпочечника, вероятно, вследствие того, что они несколько повышают уровень глюкозы в крови. Действие инсулина связано с повышением активности внутриклеточной фосфодиэстеразы, что приводит к снижению концентрации цАМФ и угнетению липолиза. Таким образом, инсулин усиливает синтез жира и уменьшает скорость его мобилизации. Имеются данные, свидетельствующие о возможности прямых нервных влияний на обмен жиров. Симпатические влияния тормозят синтез триглицеридов и усиливают их распад. Парасимпатические влияния, напротив, способствуют отложению жира в депо.
Статья добавлена 31 мая 2016 г.
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ АСПЕКТЫ И ОСОБЕННОСТИ КЛИНИЧЕСКОГО ТЕЧЕНИЯ НЕКОТОРЫХ ФОРМ ГИПЕРТРОФИЧЕСКОЙ КАРДИОМИОПАТИИ


dilated cardiomyopathy, hypertrophic cardiomyopathy, cardiocyclide, left ventricle, sudden death, restrictive cardiomyopathy, cardiomyocyte, contraction proteins
 |  | Автор Костарева, А. А., Гудкова, А. Я., Семернин, Е. Н., Шляхто, Е. В. |  |  | Номера и рубрики ВА-N32 от 15/12/2003, стр. 57-61 /.. Обзоры |